Armoracia rusticana P.GAERTN., B.MEY. & SCHERB.
Armoraciae radix (Meerrettichwurzel)
Armoraciae radix recens (Frischer Meerrettich) [4]
Allgemeines
Die Resistenz von Mikroorganismen ist ein zunehmendes Problem der globalen Gesundheitsversorgung, und zwar in solch einem großen Ausmaß, dass die Weltgesundheitsorganisation (WHO) mikrobielle Resistenzen zu einer der Top 10 Gesundheitsbedrohungen für die Menschheit erklärt hat. Infektionen, die durch antibiotikaresistente Keime verursacht werden, sind schwierig und manchmal unmöglich zu behandeln. In den meisten Fällen erfordern sie verlängerte Krankenhausaufenthalte, zusätzliche Nachuntersuchungen beim Arzt und kostspielige Alternativen, die selbst negative Auswirkungen auf die Gesundheit haben können. [1]
Der ausufernde und unverantwortliche Einsatz von Antibiotika führte dazu, dass Mikroorganismen sich wappnen und ihre Überlebenschancen erhöhen mussten. Sie machen sich, um das Fortbestehen ihrer Stämme zu sichern, vielfältige Mechanismen zunutze, einer dieser Mechanismen ist der Zusammenschluss zu einem sogenannten Biofilm. In Biofilmen liegen Populationen von Mikroorganismen organisiert in einer dünnen, schützenden Polysaccharid-Schicht vor. Biofilm-assoziierte Bakterien sind weniger empfindlich gegenüber Antibiotika als freilebende (planktonische) Zellen. Darüber hinaus sind die mikrobiellen Zellen bei Schwankungen der Antibiotika-Konzentration in einem Biofilm oft Konzentrationen ausgesetzt, die unterhalb der Hemmkonzentration liegen, so können sie Resistenzen entwickeln. Dies führt zur Selektion von Erregern, die nur schwer auszurotten sind. Ein Beispiel für gehäuften Gebrauch von Antibiotika sind unkomplizierte Harnwegsinfektionen. Fachleute argumentieren mittlerweile, dass die Behandlung und Prävention unkomplizierter Harnwegsinfekte an einem Wendepunkt steht und der Nutzen einer empirischen Antibiotikatherapie möglicherweise nicht mehr den individuellen und gesellschaftlichen Risiken überwiegt. [2]
Ein großes Potential zur Bekämpfung bakterieller Infektionen stellen die sekundären Pflanzenstoffe dar, sie werden auf Grund ihre vielfältigen Eigenschaften immer mehr als Alternative oder Ergänzung zu Antibiotika in Betracht gezogen. Eine Gruppe pflanzlicher Substanzen mit solchen Eigenschaften sind die Glucosinolate (GLS). Es handelt sich um schwefelorganische Verbindungen, die in der Familie der Brassicaceae reichlich vorhanden sind. Sie kommen als Sekundär-Metabolite in verschiedenen Gemüsesorten wie Brunnenkresse, Meerrettich, Kohl-Arten und Brokkoli vor. Werden ihre Zellwände beschädigt kommt es zur Spaltung der Glucosinolate durch die, in anderen Zellkompartimenten gelagerte, Myrosinase. Die entstehenden Glucosinolat-Hydrolyseprodukte, vor allem die Isothiocyanate, sind seit langem für ihre antimikrobielle Aktivität gegen wichtige pathogene Mikroorganismen bekannt.
Die Pflanzenmonografie wurde mit freundlicher Genehmigung auf Basis der Diplomarbeit „Arzneipflanzenportraits ausgewählter Arzneidrogen“ (Mag. pharm. Antonia Kresnik) erstellt.
References
1. WHO Antimicrobial Resistance Division. 2020 antibacterial agents in clinical and preclinical development: an overview and analysis. World Health Organization. 2021 Apr 15. Available from: https://www.who.int/publications/i/item/9789240021303 [updated 2021 Apr 15; cited 2021 Jul 5].
2. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Dis Mon. 2003; 49:53–70. doi: 10.1067/mda.2003.7 PMID: 12601337.
3. World Flora Online. Lavandula angustifolia Mill. World Flora Online. 2021 [updated 7 Jun 2021; cited 7 Jun 2021]. Available from: http://www.worldfloraonline.org/taxon/wfo-0000224116.
4. Kommission E Monographie BGA/BfArM. Armoraciae rusticanae radix (Meerrettich). Monographie BGA/BfArM. ; 1988.
5. Schilcher H, Kammerer S, Wegener T, Volkmann D, editors. Leitfaden Phytotherapie. 4th ed. München: Elsevier Urban & Fischer; 2010.
6. Bäumler S. Arzneipflanzenporträts. 2nd ed. München: Elsevier Urban & Fischer; 2012.
7. World Flora Online 2021. Armoracia rusticana [updated 30 Jun 2021; cited 30 Jun 2021]. Available from: http://www.worldfloraonline.org/taxon/wfo-0000549445.
8. Pilipczuk T, Kusznierewicz B, Chmiel T, Przychodzeń W, Bartoszek A. Simultaneous determination of individual isothiocyanates in plant samples by HPLC-DAD-MS following SPE and derivatization with N-acetyl-l-cysteine. Food Chem. 2017; 214:587–96. Epub 2016/07/21. doi: 10.1016/j.foodchem.2016.07.125 PMID: 27507514.
9. Agneta R, Möllers C, Rivelli AR. Horseradish (Armoracia rusticana), a neglected medical and condiment species with a relevant glucosinolate profile: a review. Genet Resour Crop Evol. 2013; 60:1923–43. doi: 10.1007/s10722-013-0010-4.
10. Rose P, Faulkner K, Williamson G, Mithen R. 7-Methylsulfinylheptyl and 8-methylsulfinyloctyl isothiocyanates from watercress are potent inducers of phase II enzymes. Carcinogenesis. 2000; 21:1983–8. doi: 10.1093/carcin/21.11.1983 PMID: 11062158.
11. Romeo L, Iori R, Rollin P, Bramanti P, Mazzon E. Isothiocyanates: An Overview of Their Antimicrobial Activity against Human Infections. Molecules. 2018; 23:1–18. Epub 2018/03/09. doi: 10.3390/molecules23030624 PMID: 29522501.
12. Jakobsen TH, Bragason SK, Phipps RK, Christensen LD, van Gennip M, Alhede M, et al. Food as a source for quorum sensing inhibitors: iberin from horseradish revealed as a quorum sensing inhibitor of Pseudomonas aeruginosa. Appl Environ Microbiol. 2012; 78:2410–21. Epub 2012/01/27. doi: 10.1128/AEM.05992-11 PMID: 22286987.
13. Park H-W, Choi K-D, Shin I-S. Antimicrobial activity of isothiocyanates (ITCs) extracted from horseradish (Armoracia rusticana) root against oral microorganisms. Biocontrol Sci. 2013; 18:163–8. doi: 10.4265/bio.18.163 PMID: 24077540.
14. Borges A, Abreu AC, Ferreira C, Saavedra MJ, Simões LC, Simões M. Antibacterial activity and mode of action of selected glucosinolate hydrolysis products against bacterial pathogens. J Food Sci Technol. 2015; 52:4737–48. Epub 2014/09/14. doi: 10.1007/s13197-014-1533-1 PMID: 26243895.
15. Kaiser SJ, Mutters NT, Blessing B, Günther F. Natural isothiocyanates express antimicrobial activity against developing and mature biofilms of Pseudomonas aeruginosa. Fitoterapia. 2017; 119:57–63. Epub 2017/04/05. doi: 10.1016/j.fitote.2017.04.006 PMID: 28390975.
16. Mutters NT, Mampel A, Kropidlowski R, Biehler K, Günther F, Bălu I, et al. Treating urinary tract infections due to MDR E. coli with Isothiocyanates – a phytotherapeutic alternative to antibiotics. Fitoterapia. 2018; 129:237–40. Epub 2018/07/19. doi: 10.1016/j.fitote.2018.07.012 PMID: 30031115.
17. Jeong Y-J, Cho H-J, Chung F-L, Wang X, Hoe H-S, Park K-K, et al. Isothiocyanates suppress the invasion and metastasis of tumors by targeting FAK/MMP-9 activity. Oncotarget. 2017; 8:63949–62. Epub 2017/07/12. doi: 10.18632/oncotarget.19213 PMID: 28969043.
18. Herz C, Márton M-R, Tran HTT, Gründemann C, Schell J, Lamy E. Benzyl isothiocyanate but not benzyl nitrile from Brassicales plants dually blocks the COX and LOX pathway in primary human immune cells. Journal of Functional Foods. 2016; 23:135–43. doi: 10.1016/j.jff.2016.02.034.
19. Thiel, Ardjomand-Wölkart. Eine Extraktkombination aus Cranberry, Brunnenkresse und Meerrettich in der Anwendung bei Frauen mit unkompliziertem Harnwegsinfekt Lower Urinary Tract Infectbei Frauen mit unkompliziertem Harnwegsinfekt // A Complex Preparation of Cranberry, Horseradish and Watercress in the Treatment of Non-Severe Lower Urinary Tract Infect. Journal für Urologie und Urogynäkologie. 2016:4–9. Available from: https://www.kup.at/kup/pdf/13760.pdf.
20. Stange R, Schneider B, Albrecht U, Mueller V, Schnitker J, Michalsen A. Results of a randomized, prospective, double-dummy, double-blind trial to compare efficacy and safety of a herbal combination containing Tropaeoli majoris herba and Armoraciae rusticanae radix with co-trimoxazole in patients with acute and uncomplicated cystitis. Res Rep Urol. 2017; 9:43–50. Epub 2017/03/14. doi: 10.2147/RRU.S121203 PMID: 28352615.
21. Lau I, Albrecht U, Kirschner-Hermanns R. Phytotherapie bei katheterassoziierten Harnwegsinfekten : Beobachtungsstudie zur Wirksamkeit und Sicherheit einer fixen Kombination mit Kapuzinerkressenkraut und Meerrettichwurzel. Urologe A. 2018; 57:1472–80. doi: 10.1007/s00120-018-0740-1 PMID: 30054678.
22. Sedaghattalab M, Razazan M, Shahpari M, Azarmehr N, Larki RA, Sadeghi H, et al. The Effect of the Hydroalcoholic Extract of Watercress on the Levels of Protein Carbonyl, Inflammatory Markers, and Vitamin E in Chronic Hemodialysis Patients. Biochem Res Int. 2021; 2021:5588464. Epub 2021/05/26. doi: 10.1155/2021/5588464 PMID: 34136285.
Armoracia rusticana wächst bevorzugt auf sandigen, feuchten Böden und gehört, wie die Brunnenkresse, der Familie der Kreuzblütler an. Als Überdauerungsorgan bildet er eine rübenförmige, holzige hell gelblich-weiße Wurzel, die sich weiträumig waagrecht ausbreitet. Der Meerrettich ist eine krautige, mehrjährige Pflanze, die 0,5 bis 1,5 m hoch werden kann. Seine Blätter sind lang, gestielt und gekerbt mit kräftig hervortretenden Mittelrippen und gezähntem Blattrand. Er hat wenige Grundblätter, die Blattspreite ist breit und länglich-lanzettlich oder eiförmig. Die unteren und mittleren Laubblätter sind kurz gestielt, fiederspaltig mit länglichen bis linealisch-länglichen Lappen und laufen am Grund spitz zu. Die 2 – 4 mm großen Kelchblätter sind eiförmig, die Blütenblätter verkehrt eiförmig oder länglich (5 – 8 mm).
Der Blütenschaft schießt aus der Mitte der Blattrippen hervor. In der Blütezeit von Mai bis Juli, bilden sich weiße, wohlriechende Blüten, die in Rispen angeordnet sind. Als Früchte bildet der Meerrettich kleine, ca. 0,5 cm große, kugelige Schötchen, die glatte Samen enthalten. [6,7]

Droge
Die weiße circa 20 cm lange Wurzel des Meerrettichs Armoraciae radix wird frisch, Armoraciae radix recens, oder getrocknet verwendet, Armoraciae rusticana radix (Syn. Radix Armoraciae). Ihre Erntezeit ist vorwiegend im Frühjahr und Herbst. [6]
Bestandteile
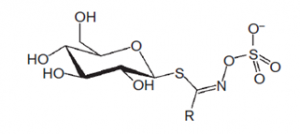 Abbildung: Die Grundstruktur der Glucosinolate. (Eigene Formelzeichnung)
Abbildung: Die Grundstruktur der Glucosinolate. (Eigene Formelzeichnung)
Die wirksamkeitsbestimmenden Bestandteile der Brunnenkresse und des Meerrettichs sind die Senfölglykoside oder Glucosinolate, von denen 2-Phenylethylglucosinolat, bekannt als Gluconasturtiin, am höchsten konzentriert ist. Die Senfölglykoside oder Thiolglykoside gehören, wie der Name schon sagt, der Stoffgruppe der Glykoside an und bestehen strukturell aus einem Aglykon, das über ein Schwefelatom an einen Zucker gebunden ist. Diese sekundären Pflanzenstoffe kommen vorwiegend in Kreuzblütlern wie Kresse, Meerrettich, Senf und Kohl vor, die ihnen ihren bitteren, scharfen Geschmack zu verdanken haben. Thiolglykoside sind schwefel- und stickstoffhaltige Verbindungen, die vorwiegend in der frischen Pflanze vorkommen, da bei der Ernte ein Großteil von ihnen verloren geht. Werden nämlich die Zellwände der Pflanzen verletzt, wird die, für die Kreuzblütler typische, Myrosinase (β-Thiolglucosidase) freigesetzt. Die Myrosinase ist ein pflanzliches Enzym, das räumlich getrennt von ihrem Substrat, dem Senfölglykosid, vorliegt und es bei Kontakt in Glucose und Senföle spaltet. Wird die Zellstruktur durch Trocknung oder falsche Lagerung zerstört, gehen auch die flüchtigen Senföle und mit ihnen die Hauptwirkstoffe der Pflanzen verloren. [6]
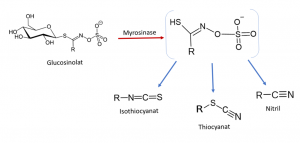
Abbildung: Der Abbau von Glucosinolaten durch die Myrosinase. (Eigene Formelzeichnung)
Im Meerrettich sind die am höchsten konzentrierten Glucosinolate Sinigrin (Allylglucosinolat ca. 0,15%) und Gluconasturtiin (ca. 0,1%), sie sind nur in frischer Zubereitung wirksam. Wird das Gewebe zerstört wird Sinigrin durch die Myrosinase zu Allylsenföl und Gluconasturtiin zu 2-Phenylethylisothiocyanat gespalten. [6]
Im frischen Kraut:
- Glucosinolate: 0,2 – 0,6%
- Sinigrin: 0,15 %
- Gluconasturtiin: ca 0,1 %
- Glucobrassicanapin
- Glucoiberin
- Glucohesperin
- Flavonoide (Quercetin, Kämpferol)
- Ascorbinsäure (ca. 0,6%)
- Vitamin B1 (ca. 500μg/100g)
- Kaliumsalze
In den getrockneten Blättern:
- Isothiocyanate
- 2-Phenylethyl-ITC (PEITC)
- Hirsutin (8-Methylsulfinylocytl-ITC)
- Benzyl-ITC (BITC)
- Indol-3-ylmethyl-ITC
- Sulforaphan
- Nitrile
- 3-Phenyl-proprionitril
- Myristicin
[6,8,9]
Meerrettichsaft wurde traditionell bei Lenden- und Steinleiden eingesetzt, bereits Plinius bezeichnete ihn als Emmenagogum und Diuretikum. Hildegard von Bingen nutzte ihn bei Schmerzen in der Brust und dem Bauchraum, so auch gegen Blähungen, hartnäckigen Husten, bei Natternbissen und Pilzvergiftungen. Darüber hinaus fand er Verwendung als Konservierungsmittel für Speisen. In der englischen Volksheilkunde wurde der Meerrettich gegen Gelenksbeschwerden eingesetzt und bei Entzündungen des Mund- und Rachenraumes eine Gurgellösung aus Meerrettichpulver hergestellt. Dass die Pflanze oft wild an Küstengebieten wuchs und die Seefahrer sie als Vitamin C Quelle mitnahmen und gegen Skorbut und Wassersucht nutzten, könnte eine Möglichkeit für ihre Namensgebung sein. Der Meerrettich wurde außerdem wegen seiner antiinfektiven Eigenschaften bereits früh als „pflanzliches Antibiotikum“ bezeichnet. [6]
Kommission E / ESCOP / EMA / HMPC
Es besteht eine Positiv-Monographie der Kommission E zur Meerrettichwurzel für die Anwendung bei Katarrhen der Atemwege und als Hilfsmittel bei Infektionen der ableitenden Harnwege, außerdem äußerlich bei Prellungen und Muskelschmerzen. [4,5] Von der ESCOP und dem HMPC wurde die Meerrettichwurzel bisher noch nicht bearbeitet
Innerlich
Die mittlere Tagesdosis beträgt 20 g der frischen Wurzel.
Zur Behandlung bakterieller Harnwegsinfekte werden 10 – 25 g zerriebene Meerrettichwurzel zugeführt.
Äußerlich
Zubereitungen mit max. 2% Senfölen.
[6]
Unerwünschte Wirkungen
Kann Schleimhaut reizende Wirkung haben, sollte daher nicht länger als 4 – 6 Wochen angewendet werden. [6]
Gegenanzeigen/Anwendungsbeschränkungen
Keine Anwendung bei Kindern unter 4 Jahren. Bei Magen- und Darmulzera sowie Nephritiden sollte ebenfalls von der Verwendung abgesehen werden. [6]
Wechselwirkungen
Keine bekannt. [5,6]
Pharmakokinetik
Es wird angenommen, dass Glucosinolate Phase-I- und Phase-II-Enzyme modulieren können. Brunnenkresse beinhaltet zwei strukturell unterschiedliche Gruppen von Glucosinolat-Metaboliten mit biologischer Aktivität. Zum einen β-Phenylethylisothiocyanat (PEITC), abgeleitet von Phenylalanin, das Phase-I-Enzyme (Cytochrom P450) hemmt und Phase-II-Enzymen induziert und zum anderen langkettige Methylsulfinylalkyl-Isothiocyanate, abgeleitet von Methionin, die potente Phase-II-Enzyminduktoren sind. [11]
Der Metabolismus von Glucosinolaten im menschlichen Körper erfolgt beginnend mit ihrer Absorption durch die gastrointestinale Schleimhaut. Der größte Teil der aufgenommenen Glucosinolate wird im Darmlumen metabolisiert, insbesondere wenn rohes Brassica-Gemüse verzehrt wird. Die Myrosinase hydrolysiert die Glucosinolate und verschiedene Metaboliten, einschließlich Isothiocyanate, aber auch Nitrile, Oxazolidin-2-thione und Indol-3-carbinole, die dann im Magen und Dünndarm absorbiert werden. Senföle, die aus gekochtem Brassica-Gemüse stammen (inaktivierte Myrosinase) gelangen, da sie noch intakt und hydrophil sind, in den Dickdarm (Thioglukose- und Sulfatgruppen), wo sie von Mikroorganismen zu Glucosinolat-Abbauprodukten hydrolysiert und schließlich von der Schleimhaut absorbiert werden. Die höchsten Mengen an ITC finden sich in der Darmschleimhaut, der Leber, den Nieren und der Harnblase, gefolgt von Lunge und Milz. Die absorbierten ITC gelangen in die Leber, wo sie mit Glutathion konjugiert und schließlich als Mercaptursäure im Urin ausgeschieden werden. Die Bioverfügbarkeit der ITC und damit ihre Elimination hängt insbesondere von der Art der Glucosinolat-Hydrolyse und von ihrem Gehalt ab. [14]
In-vitro-Studien
Antibakterieller Effekt
Eine Reihe gängiger natürlicher Lebensmittelprodukte und Pflanzen wurde auf ihre Quorum-Sensing-Hemmaktivität (QSI) getestet. Zur Identifizierung der aktiven Verbindungen wurden Diodenarray-Detektor-Massenspektrometrie (LC-DAD-MS) und Kernspinresonanz-spektroskopie (NMR) verwendet. Armoracia rusticana stach aus einer Gruppe aktiver Rohextrakte als hochaktiv in Bezug auf die QSI-Aktivität gegen Pseudomonas aeruginosa heraus. Fraktionierung und Aufreinigung führten zur Identifizierung von 3-Methylsulfinyl-propyl-ITC, allgemein bekannt als Iberin, als aktive QSI-Verbindung im Meerrettich. Echtzeit PCR und DNA-Microarray-Analyse der globalen Genexpression zeigten, dass Iberin spezifisch und äußerst wirksam zwei der wichtigsten QS-Netzwerke in Pseudomonas aeruginosa, das LasIR- und das RhlIR-System, angreift und sowohl die QS-gesteuerte Rhamnolipid-Produktion als auch die Produktion des Pseudomonas-Quinolon-Signals (PQS), herunterreguliert. Rhamnolipide sind Glykolipide, die Pseudomonas aeruginosa als Teil der Biofilmstruktur ausbilden, während es sich beim PQS um ein wichtiges Signalmolekül der bakteriellen Kommunikation handelt. In den mit 8 µg/ml Iberin behandelten Kulturen von Pseudomonas aeruginosa wurde, im Vergleich zu unbehandelten, eine etwa 10-fach niedrigere Konzentration von Rhamnolipiden gesehen. Durch Behandlung mit 32 µg/ml Iberin wurde die Produktion von Rhamnolipiden vollständig unterdrückt. Es wurde gezeigt, dass Konzentrationen über 1,0 mM Iberin zu einer signifikanten Wachstumshemmung von Pseudomonas aeruginosa führen können. [12]
Die antimikrobielle Aktivität von Isothiocyanaten (ITC), extrahiert aus der Meerrettichwurzel, wurde gegen orale Mikroorganismen untersucht. Es wurden sechs Stämme fakultativ anaerober Bakterien getestet (Streptococcus mutans, Streptococcus sobrinus, Lactobacillus casei, Staphylococcus aureus, Enterococcus faecalis, Aggregatibacter actinomycetemcomitans), der Hefepilz Candida albicans und drei Stämme anaerober Bakterien (Fusobacterium nucleatum, Prevotella nigrescens, Clostridium perfringens).
ITC zeigten in der Papierscheiben-Methode antimikrobielle Aktivität gegen alle oralen Mikroorganismen. Die minimale bakterizide Konzentration (MBK), der aus der Meerrettichwurzel extrahierten ITC reichte von 1,25 bis 5,00 mg/ml gegen alle Stämme der fakultativ anaeroben Bakterien und den Hefestamm und von 4,17 bis 16,67 mg/ml gegen die anaerobe Bakterienstämme. Die stärkste antimikrobielle Aktivität, mit einer minimalen fungiziden Konzentration von 1,25 mg/ml wurde gegen Candida albicans ermittelt. [13]
In einer Publikation von Borges et al. untersuchte man die antimikrobielle Aktivität und Wirkungsweise von AITC und PEITC gegen Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus und Listeria monocytogenes. Zu diesem Zweck wurden einerseits die minimale Hemmkonzentration (MHK) und die minimale bakterizide Konzentration (MBC) bestimmt und andererseits die, durch die Istohiocyanate induzierten, physiologischen Veränderungen an den Bakterienzellen betrachtet. Die Analyse der antimikrobiellen Aktivität zeigte, dass AITC und PEITC eine MHK von 100 μg/mL gegen alle getesteten Bakterien aufwiesen. Sie wirkten beide durch Veränderung der Membraneigenschaften der Bakterien und verringerten dadurch ihre Oberflächenladung und beeinträchtigen die Integrität der
Zytoplasma-Membran, was zu Kaliumverlusten führte. Zudem konnten unspezifische Auswirkungen auf die Oberflächenhydrophobie beobachtet werden. Durch diese verschiedenen Wirkmechanismen wird vor allem die Bildung von Resistenzen der Mikroorganismen deutlich erschwert. [14]
Alle einzelnen Isothiocyanate konnten in einer 2017 durchgeführten In-vitro-Studie planktonische Pseudomonas aeruginosa und auch bereits entstandene Biofilme terminieren. Es wird vermutet, dass sogar schon geringe Konzentrationen an ITC die Biofilmbildung verhindern, die Lebensfähigkeit des Biofilms stören und die Wirkung von Antibiotika synergistisch erleichtern, auch wenn das Wachstum nicht komplett gehemmt werden kann. [15]
Uropathogene Escherichia coli (UPEC) sind eine Spezies, die besonders häufig bei Harnwegsinfektionen isoliert wird. Sie sind in der Lage, die antibiotische Behandlung durch Internalisierung zu überleben und Rezidive zu verursachen. Es wurden 217 klinische UPEC-Isolate, von denen 54,5 % als Antibiotika-resistent (MDR) klassifiziert wurden, auf Empfindlichkeit gegen die Isothiocyanate Allyl-ITC, Benzyl-ITC und 2-Phenylethyl-ITC, getestet. Die minimalen Hemmkonzentrationen (MHK) reichten von < 0,02 bis 0,67 mg ITC/ml. Die mittlere Gesamt-MHK-90 zeigte, dass eine Konzentration von 0,17 mg ITC/ml notwendig war, um das sichtbare bakterielle Wachstum in 90 % (200/217) aller getesteten Stämme zu hemmen. Die Daten wiesen auf eine starke antimikrobielle Aktivität der ITC gegen UPEC, dargestellt durch sehr niedrige MHK-90-Werte, hin. Zusätzlich waren die ITC in der Lage die Internalisierung von UPEC in menschliche Uroepithelzellen, insbesondere nach längerer Inkubationszeit, zu hemmen. [16]
Antiproliferative Wirkung
Isothiocyanate können die Invasion und Metastasierung von Tumoren unterdrücken. Von den verschiedenen Isothiocyanaten zeigten besonders Benzylisothiocyanat (BITC), Phenethylisothiocyanat (PEITC) und Sulforaphan (SFN aus dem Brokkoli) gute Wirksamkeit in präklinischen Krebsmodellen. Sie scheinen über verschiedene Mechanismen wie Induktion von Apoptose und oxidativem Stress sowie Hemmung der Zellzyklusprogression zu wirken. Darüber hinaus regulieren sie verschiedene Signalwege und hemmen die Expression und Aktivität von Matrix-Metalloproteinasen (MMP-9 und MMP-2). MMP-9 und MMP-2 sind Schlüsselenzyme, die mit der Tumorinvasion, dem Abbau von Knochengewebe und der Angiogenese in Verbindung gebracht werden. Die Aktivität von MMP-9 wird durch Wachstumsfaktoren (Aktivatorprotein 1 (AP-1), Nuclear Factor κB (NF-κB) und Zytokine erhöht und die Sekretion durch die fokale Adhäsionskinase (FAK) gefördert. PEITC unterdrückte sowohl die MMP-2-Aktivität als auch die TPA-induzierte MMP-9-Aktivität in U20S-, Caski- und T98G-Zellen in dosisabhängiger Weise. BITC, PEITC und SFN hemmten außerdem die Aktivität von AP-1 und NF-κB. Um schließlich zu untersuchen, ob Isothiocyanate das Tumorwachstum auch in vivo hemmen, wurden Mäusen A549-Zellen-Tumorzellen injiziert. Nachdem der Tumor eine Größe von 5 mm erreicht hatte, wurden den Mäusen 5 Wochen lang intraperitoneal die Isothiocyanat-Verbindungen verabreicht. Die maximale Tumorgröße in PEITC-behandelten Mäusen war deutlich kleiner als in den anderen Gruppen. Ki67, ein Marker der Zellproliferation, wurde durch Isothiocyanate, aber nicht durch das Vehikel unterdrückt. Diese Ergebnisse deuten darauf hin, dass Isothiocyanate die Proliferation von A549-Zellen und die anschließende Tumorentwicklung blockieren können. [17]
Entzündungshemmende Wirkung
Die Arachidonsäure (AA) ist ein wichtiger Marker der Entzündungsreaktion, sie wird unter anderem von Bakterien durch Freisetzung von Lipopolysacchariden (LPS) aus ihrer Membran erzeugt. AA kann über zwei Hauptwege weiter verstoffwechselt werden, den Cyclooxygenase- (COX) und den Lipoxygenase-Stoffwechselweg (LOX). Bislang wurden drei Isoformen der COX identifiziert. COX-2 ist eines der wichtigsten Enzyme bei der Entzündungsreaktion, da es entscheidend für die Bildung von Prostaglandinen ist, wobei Prostaglandin E2 (PGE2) verantwortlich für Symptome wie Fieber und Schmerzen ist. In den letzten Jahren wurde die duale Hemmung sowohl des COX- als auch des LOX-Signalwegs als ein vielversprechender neuer Ansatz zur Entzündungshemmung mit keiner oder nur geringer Toxizität angesehen. Die duale Hemmung des COX/LOX-Signalweges durch Benzyl-ITC (BITC) oder seinem Nitril-Pendant wurden an Zellen des menschlichen Immunsystems untersucht. Verwendet wurden aktivierte primäre menschliche mononukleäre Blutzellen (PBMC). Es wurde gezeigt, dass BITC, nicht aber Benzylnitril oder Phenylethylnitril, die zelluläre proinflammatorische Reaktion über den dualen COX/LOX-Signalweg vermindern kann. Benzyl-ITC unterdrückte außerdem die durch LPS ausgelöste Aktivierung des COX-Signalwegs in menschlichen PBMC. Benzyl-ITC blockierte weiters die Freisetzung von Leukotrien B4 (LTB4) in humanen PBMC und reduzierte die Aktivierung und Funktion von aktivierten T-Lymphozyten. [18]
Harnwegsinfektionen
In einer Beobachtungsstudie wurden 48 Frauen, die an Harnwegsinfektionen (HWI) litten, mit einem standardisierten Cranberry-Extrakt (67 mg Proanthocyanidine) in Kombination mit glucosinolathaltigen Extrakten von Brunnenkresse (Nasturtium officinale) und Meerrettich (Armoracia rusticana) behandelt. Die klinischen Symptome waren erhöhte Leukozyten-Werte im Urin, Dysurie, Harndrang, Inkontinenz und Schmerzen. Die Probandinnen erhielten in der ersten Woche zweimal tägliche eine der Tabletten des Kombinations-Phytotherapeutikums. In den darauffolgenden vier Wochen nahmen sie nur mehr eine Tablette täglich ein. Nach 14 (t1) und nach 35 (t2) Tagen wurde eine Befragung und Kontrolluntersuchung mit einem Urintest durchgeführt. Patientinnen mit anhaltenden klinischen Symptomen erhielten ein Antibiotikum, bei den anderen wurde die Einnahme der Tabletten mit dem Extrakt-Präparat fortgesetzt. Bei 34 Patientinnen (70,8 %) konnten die Einnahme von Antibiotika innerhalb der ersten 14 Tagen vermieden werden, bei 32 Patientinnen (66,7 %) wurde auch danach keine antibiotische Therapie benötigt. 28 Patientinnen (87,5 %) waren zum Zeitpunkt t2 symptomfrei. Es wurden keine unerwünschten Ereignisse beobachtet. Die Kombination von Brunnenkresse, Meerrettich und Cranberry kann bei Harnwegsinfekten hilfreich sein, die körpereigene Abwehr zu stärken und den Zusatz von Antibiotika zu vermindern oder ganz auf sie zu verzichten. Außerdem könnten so Resistenzbildung vermieden und Rezidive verringert werden. [19]
In einer randomisierten, prospektiven, doppelblinden, aktiv-kontrollierten, multizentrischen, klinischen Studie der Phase III wurden ambulante PatientInnen zwischen 18 und 70 Jahren mit Symptomen einer akuten unkomplizierten Zystitis, vorhandenen Leukozyten und einer Keimzahl von mehr als 105 KBE/ml (Koloniebildende Einheiten) untersucht. Die Studienmedikation bestand aus entweder einem Kombinationspräparat mit 80 mg Meerrettichwurzelpulver und 200 mg Kapuzinerkrautpulver, dessen Isothiocyanat-Profil ähnlich dem der Brunnenkresse ist, oder dem Vergleichsstoff Co-Trimoxazol (160 mg Trimethoprim und 800 mg Sulfamethoxazol). Die Placebo-Tabletten waren vom Aussehen her identisch mit dem jeweiligen Studienmedikament. Der primäre Endpunkt war die Rate der Responder, definiert als die Reduktion der Erreger im Urin auf <103 KBE/ml beim dritten Arztbesuch. Sekundäre Endpunkte waren die Veränderung der Symptom-Scores, die Dauer der Symptome, die Beurteilung der Wirksamkeit durch die Ärzte, die Häufigkeit von Rückfällen oder Neuinfektionen beim dritten und vierten Arztbesuch sowie die Beurteilung des Krankheitsverlaufs durch die Ärzte. Obwohl die Nicht-Unterlegenheit für den primären Endpunkt in dieser Studie nicht nachgewiesen werden konnte, lagen die Responder-Raten für beide Therapien bei etwa 50 % und es wurde eine ähnliche Verbesserung der HWI-Symptome in beiden Gruppen beobachtet. 51 PatientInnen wurden als Per-Protokoll-PatientInnen betrachtet (22 in der Phytotherapie-Gruppe, 29 in der Antibiotika-Gruppe). Die Responder-Raten betrugen 10/22 (45,5 %) in der Phytotherapie-Gruppe und 15/29 (51,1 %) in der Antibiotika-Gruppe (Gruppenunterschied: -6,27 % [95 % CI: -33,90 %, -21,3 %]). Die Studie musste wegen zu geringer Rekrutierungsraten vorzeitig abgebrochen werden, trotzdem ergaben sich Hinweise auf eine vergleichbare Wirksamkeit. [20]
96 stationäre PatientInnen mit Katheter-assoziierten-Harnwegsinfektionen schlossen erfolgreich eine dreiarmige, fünfwöchige Beobachtungsstudie ab. Es wurden drei PatientInnen-Gruppen untersucht. Eine Gruppe erhielt Kapseln mit Kapuzinerkressenkraut 200 mg und Meerrettichwurzel 80 mg als Monotherapie. Die zweite Gruppe erhielt das gleiche Phytotherapeutikum in Kombination mit einem Antibiotikum (Add-on) und die dritte Gruppe erhielt das Antibiotikum allein. Zu den Endpunkten gehörten Erregerzahl und Resistenzspektrum im Urin, Entzündungsmarker im Blut, Antibiotikaverbrauch, unerwünschte Ereignisse (AE), unerwünschte Arzneimittelwirkungen (UAW), Wirksamkeit und Verträglichkeit. Alle initialen Harnwegsinfekte waren mit der Add-on-Therapie und der reinen Antibiotikatherapie nach durchschnittlich 10,5 bzw. 9 Tagen abgeheilt. Die phytotherapeutische Monotherapie führte zu einer erfolgreichen Behandlungsrate von 46% nach durchschnittlich 28 Tagen. Die Dosierungen lagen mit 3 × 4 bzw. 3 × 3 Tabletten pro Tag deutlich unter der empfohlenen oberen Dosierungsstufe. Die Rezidivrate der Harnwegsinfekte war unter der Kombinationstherapie deutlich reduziert (jeweils 50%), im Gegensatz zur reinen Antibiotikatherapie (79,3%). Auch die Inzidenz von AE und UAW war in der Monotherapiegruppe (23,8%) geringer als in der Add-on-Therapiegruppe (44,8%) und der reinen Antibiotikagruppe (34,5%). Mono- und Add-on-Therapien mit dem pflanzlichen Arzneimittel reduzierten das Rezidiv von Katheter-assoziierten-Harnwegsinfektionen im Vergleich zur alleinigen Antibiotikatherapie deutlich. Daraus ergibt sich eine potenzielle prophylaktische Wirksamkeit des ITC-Präparates, das eine vielversprechende Alternative für die Behandlung und Vorbeugung von rezidivierenden Katheter-assoziierten-Harnwegsinfektionen darstellen und den Einsatz von Antibiotika reduzieren könnte. [21]
Nierenerkrankungen
Eine doppelblinde, randomisierte klinische Studie, die an 45 Hämodialyse-PatientInnen durchgeführt wurde, hatte zum Ziel, die Wirkung eines hydroalkoholischen Extrakts der Brunnenkresse auf die inflammatorischen Zytokine und den Protein-Carbonyl-Gehalt (PCO) bei chronischen Nierenerkrankungen zu untersuchen. Oxidativer Stress tritt vermehrt bei Nierenversagen und Hämodialyse auf und kann zu Proteinoxidation führen. Die Bildung von PCO in Proteinen geschieht durch direkte Oxidation über Reaktive Sauerstoffspezies (ROS). Die TeilnehmerInnen wurden nach dem Zufallsprinzip in zwei Gruppen aufgeteilt: 22 in der Interventionsgruppe (500 mg hydroalkoholischer Extrakt aus Brunnenkresse jeden Tag für 4 Wochen) und 23 in der Kontrollgruppe (500 mg Weißmehl jede Nacht für 4 Wochen). Die Spiegel von Vitamin E, PCO und inflammatorischen Zytokinen wurden zu Beginn und am Ende der Behandlung anhand von Blutproben bestimmt. In der Interventionsgruppe kam es zu einer signifikanten Reduktion der PCO-Werte (20,33 ± 4,40 vs. 15,06 ± 6,41, p = 0,001). Weiterhin gab es signifikante Reduktionen der Entzündungsmarker hochsensitives C-reaktives Protein (hs-CRP) (8953,30 ± 5588,06 vs. 7249,86 ± 5091,62, p = 0,007) und Interleukin 6 (IL-6) (60,10 vs. 55,21, p = 0,050) in der Interventionsgruppe, diese Veränderungen waren jedoch im Vergleich mit der Kontrollgruppe nicht signifikant. Der hydroalkoholische Extrakt der Brunnenkresse reduzierte, über die Hemmung der Proteinoxidation, den PCO-Gehalt bei Hämodialyse-PatientInnen. Obwohl die Verabreichung von Brunnenkresse eine signifikante Senkung der IL-6- und CRP-Werte bewirkte, waren diese Unterschiede im Vergleich zur Kontrollgruppe statistisch nicht signifikant. [22]


