 Botanischer Name
Botanischer Name
Pelargonium sidoides DC
Familie
Geraniaceae
Gattung:
Pelargonium
Klasse:
Magnoliopsida
Synonyme
Südafrikanische Kapland-Pelargonie, Umckaloabo, South African Geranium, Kalwerbossie, Rabassam (engl.), Geranium du Cap (franz.)
Pflanzenteil
Pelargonii sidoidi radix
Definition der Droge
Verwendet werden die getrockneten Wurzeln von Pelargonium sidoides in flüssiger bzw. fester Darreichungsform
(Ema/Hmpc, 2011; Wichtl & Blaschek, 2016)
Nachweise:
Die Monografie entstand mit freundlicher Genehmigung nach einer Diplomarbeit von Elisa Olalde Quintanar (2022).
Adams, K.K., W.L. Baker, & D.M. Sobieraj, 2020: Myth Busters: Dietary Supplements and COVID-19. Ann. Pharmacother. 54(8), 820–826. doi: 10.1177/1060028020928052.
Akbar, S., 2020: Handbook of 200 Medicinal Plants: A Comprehensive Review of Their Traditional Medical Uses and Scientific Justifications. Springer International Publishing AG.
Alhajj, M.S., M.A. Qasem, & S.I. Al-Mufarrej, 2020: Inhibitory Activity of Illicium verum Extracts against Avian Viruses. Adv. Virol. 2020, 1–8. doi: 10.1155/2020/4594635.
Altamirano-Dimas, M., J.B. Hudson, D. Cochrane, C. Nelson, & J.T. Arnason, 2007: Modulation of immune response gene expression by echinacea extracts: Results of a gene array analysis. Can. J. Physiol. Pharmacol. 85(11), 1091–1098. doi: 10.1139/Y07-110.
Aprotosoaie, A.C., I.I. Costache, & A. Miron, 2016: Anethole and its role in chronic diseases. Adv. Exp. Med. Biol. 929, 247–267. doi: 10.1007/978-3-319-41342-6_11.
Ardjomand-Woelkart, K., & R. Bauer, 2015: Review and Assessment of Medicinal Safety Data of Orally Used Echinacea Preparations. Planta Med. 82(1–2), 17–31. doi: 10.1055/s-0035-1558096.
Ardjomand-Woelkart, K., M. Kollroser, C. Magnes, F. Sinner, R.F. Frye, et al., 2011: Absolute / Relative Bioavailability and Metabolism of Dodeca-2 E , 4 E , 8 Z , 10 E / Z -Tetraenoic Acid Isobutylamides ( Tetraenes ) after Intravenous and Oral Single Doses to Rats. Planta Med 77(16), 1794–9. doi: 10.1055/s-0030.1271120.
Assiry, A.A., M.I. Karobari, S.K. Bhavikatti, & A. Marya, 2021: Crossover Analysis of the Astringent, Antimicrobial, and Anti-inflammatory Effects of Illicium verum/Star Anise in the Oral Cavity. Biomed Res. Int. 2021, 1–6. doi: 10.1155/2021/5510174.
Bäumler, S., 2007: Heilpflanzen Praxis Heute Porträts Rezepturen Anwendung. Elsevier GmbH, Urban & Fischer Verlag.
Benson, J.M., A.J. Pokorny, A. Rhule, C.A. Wenner, N.B. Cech, et al., 2010: Echinacea purpurea extracts modulate murine dendritic cell fate and function and function. Food Chem Toxicol. 48(5), 1170–1177. doi: 10.1016/j.fct.2010.02.007.
Bertelli, A.A.E., C. Mannari, S. Santi, C. Filippi, M. Migliori, et al., 2008: Immunmodulatory Activity of Shikimic Acid and Quercitin in Comparison With Oseltamivir (Tamiflu) in an “In Vitro” Model. J. Med. Virol. 80, 741–745. doi: 10.1002/jmv.21072.
Brendler, T., & B.E. van Wyk, 2008: A historical, scientific and commercial perspective on the medicinal use of Pelargonium sidoides (Geraniaceae). J. Ethnopharmacol. 119, 420–433. doi: 10.1016/j.jep.2008.07.037.
Brinkeborn, R.M., D. V. Shah, & F.H. Degenring, 1999: Echinaforce® and other Echinacea fresh plant preparations in the treatment of the common cold: A randomized, placebo controlled, double-blind clinical trial. Phytomedicine 6(1), 1–6. doi: 10.1016/S0944-7113(99)80027-0.
Choi, H.J., J.H. Song, L.R. Bhatt, & S.H. Baek, 2010: Anti-human rhinovirus activity of gallic acid possessing antioxidant capacity. Phyther. Res. 24(9), 1292–1296. doi: 10.1002/ptr.3101.
Chouksey, D., N. Upmanyu, & R.S. Pawar, 2013: Central nervous system activity of Illicium verum fruit extracts. Asian Pac. J. Trop. Med. 6(11), 869–875. doi: 10.1016/S1995-7645(13)60155-8.
Chrubasik, S., 2015: A review of pharmacological effects and clinical efficacy of fruit products and functional foods from elderberry (Sambucus spp.) as compared with chokeberry (Aronia melanocarpa). Acta Hortic. 1061, 89–92. doi: 10.17660/ActaHortic.2015.1061.8.
Cohen, H.A.M., I.M. Varsano, E.M.M. Kahan, Mi.E.M. Sarrell, & Y.M. Uziel, 2004: Effectiveness of an Herbal Preparation Containing Echinacea, Propolis, and Vitamin C in Preventing Respiratory Tract Infections in Children. Arch Pediatr Asolesc Med 158, 217–221. doi: 10.1001/archpedi.158.3.217.
Committee on Herbal Medicinal Products (HMPC), 2014a: Assessment report on Sambucus nigra L., fructus. Eur. Med. Agency, 1–25. https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-sambucus-nigra-l-fructus_en.pdf.
Committee on Herbal Medicinal Products (HMPC), 2014b: Assessment report on Echinacea purpurea (L.)Moench. herba recens. EMA, 1–73. https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-echinacea-purpurea-l-moench-herba-recens_en.pdf.
Committee on Herbal Medicinal Products (HMPC), 2016: Assessment report on Echinacea purpurea (L.) Moench,radix. Eur. Med. Agency 44(November), 1–73. www.ema.europa.eu/contact.
Conrad, A., & U. Frank, 2008: Extract of Pelargonium sidoides (EPs® 7630) displays anti-infective properties by enhanced phagocytosis and differential modulation of host-bacteria interactions. Planta Med. 74(6), 682–685. doi: 10.1055/s-2008-1034287.
Conrad, A., C. Hansmann, I. Engels, F.D. Daschner, & U. Frank, 2007: Extract of Pelargonium sidoides (EPs® 7630) improves phagocytosis, oxidative burst, and intracellular killing of human peripheral blood phagocytes in vitro. Phytomedicine 14(SUPPL. 1), 46–51. doi: 10.1016/j.phymed.2006.11.016.
De, M., A.K. De, P. Sen, & A.B. Banerjee, 2002: Antimicrobial properties of Star anise (Illicium verum Hook f). Phyther. Res. 16(1), 94–95. doi: 10.1002/ptr.989.
Diagnosia Premium, 2022: ATC Baum. Apoverlag. https://premium.diagnosia.com/index/atc/search (accessed 16 February 2022).
Dinesha, R., T. Ss, S. Kl, P. Msl, M. Cs, et al., 2014: The antioxidant and DNA protectant activities of Star Anise (Illicium verum) aqueous extracts. J. Pharmacogn. Phytochem. 2(5), 98–103.
Ema/Hmpc, 2011: Assessment report on Pelargonium sidoides DC and / or Pelargonium reniforme Curt ., radix. Eur. Med. Agency, 1–8.
Ema/Hmpc, 2018: European Union herbal monograph on Pelargonium sidoides DC and/or Pelargonium reniforme Curt., radix. Eur. Med. Agency (June), 1–38. https://www.ema.europa.eu/en/documents/herbal-monograph/final-european-union-herbal-monograph-pelargonium-sidoides-dc/pelargonium-reniforme-curt-radix-revision-1_en.pdf.
Emea, 2000: Commitee for Veterinary Medicine Products: Anisi Stellati Fructus. Vet. Med. Inf. Technol. Unit (January), 6–7.
Escop, 2015: Pelargonii radix, Pelargonium Root (S. Mills and R. Hutchins, editors). European Scientific Cooperative on Phytotherapy (ESCOP), United Kingdom.
Europäisches Arzneibuch – European Pharmacopoe, 2020: Sternanis-Anisi stellati fructus. 10. Ausgab. Deutscher Apotheker Verlag, Germany.
Gesundheit.gv.at, International Normalised Ration (INR). https://www.gesundheit.gv.at/labor/laborwerte/blutgerinnung/international-normalised-ratio (accessed 6 February 2022).
Goel, V., C. Chang, J. V. Slama, R. Barton, R. Bauer, et al., 2002: Alkylamides of Echinacea purpurea stimulate alveolar macrophage function in normal rats. Int. Immunopharmacol. 2(2–3), 381–387. doi: 10.1016/S1567-5769(01)00163-1.
Goel, V., R. Lovlin, C. Chang, J.Y. Slama, R. Barton, et al., 2005: A proprietary extract from the Echinacea plant (Echinacea purpurea) enhances systemic immune response during a common cold. Phyther. Res. 19(8), 689–694. doi: 10.1002/ptr.1733.
Habeballa, R.S., E.A. Ibrahim, N.S. Awad, & M.A. Abdein, 2020: In vitro antiviral activity of Illicium verum and Zingiber officinale ethanolic extracts. Med. Sci. 24(September), 3469–3480. https://www.discoveryjournals.org/medicalscience/current_issue/v24/n105/A85.pdf (accessed 1 February 2022).
Hudson, J.B., 2010: The multiple actions of the phytomedicine Echinacea in the treatment of colds and flu. J. Med. Plants Res. 4(25), 2746–2752. https://academicjournals.org/journal/JMPR/article-full-text-pdf/1BEC72322822 (accessed 3 December 2021).
Hudson, J., & S. Vimalanathan, 2011: Echinacea-A source of potent antivirals for respiratory virus infections. Pharmaceuticals 4(7), 1019–1031. doi: 10.3390/ph4071019.
Ize-Ludlow, D., S. Ragone, I.S. Bruck, J.N. Bernstein, M. Duchowny, et al., 2004: Neurotoxicities in infants seen with the consumption of star anise tea. Pediatrics 114(5), 653–656. doi: 10.1542/peds.2004-0058.
Jawad, M., R. Schoop, A. Suter, P. Klein, & R. Eccles, 2012: Safety and efficacy profile of Echinacea purpurea to prevent common cold episodes: A randomized, double-blind, placebo-controlled trial. Evidence-based Complement. Altern. Med. 2012, 1–7. doi: 10.1155/2012/841315.
Kayser, O., & H. Kolodziej, 1997: Antibacterial activity of extracts and constituents of Pelargonium sidoides and Pelargonium reniforme. Planta Med. 63(6), 508–510. doi: 10.1055/s-2006-957752.
Kayser, O., H. Kolodziej, & A.F. Kiderlen, 2001: Immunomodulatory principles of Pelargonium sidoides. Phyther. Res. 15(2), 122–126. doi: 10.1002/ptr.785.
Khusniati, T., W.S. Kim, S. Yanagisawa, H. Kumura, & K. Shimazaki, 2008: Utilization of Japanese aromatic substances for milk preservation as estimated by vapor contact method. J. Food Saf. 28(4), 601–608. doi: 10.1111/j.1745-4565.2008.00134.x.
Kinoshita, E., K. Hayashi, H. Katayama, T. Hayashi, & A. Obata, 2012: Anti-influenza virus effects of elderberry juice and its fractions. Biosci. Biotechnol. Biochem. 76(9), 120112-1–6. doi: 10.1271/bbb.120112.
Krawitz, C., M.A. Mraheil, M. Stein, C. Imirzalioglu, E. Domann, et al., 2011: Inhibitory activity of a standardized elderberry liquid extract against clinically-relevant human respiratory bacterial pathogens and influenza A and B viruses. BMC Complement. Altern. Med. 11(1), 16. doi: 10.1186/1472-6882-11-16.
Kumar, K.M., & S. Ramaiah, 2011: Pharmacological importance of Echinacea purpurea. Int. J. Pharma Bio Sci. 2(4), 304–314. https://d1wqtxts1xzle7.cloudfront.net/52753132/echinacea-with-cover-page-v2.pdf?Expires=1651078359&Signature=E9zWKEouXBVc7LgD-nLHSNTzlAllINPRp53SxNBo2YFqB5l~FXmrjyr7U1vTmDnAeCymjnzaHUaMsYiAfXIv7yN-Il4WcqukNfzS2aclbDBhn3RkCzG106g0not0sp7mLzeQ~K7zKBk7cDDGaY (accessed 3 December 2021).
Lewu, F.B., D.S. Grierson, & A.J. Afolayan, 2006: Extracts from Pelargonium sidoides inhibit the growth of bacteria and fungi. Pharm. Biol. 44(4), 279–282. doi: 10.1080/13880200600714137.
Li, H., X. Wu, X. Li, X. Cao, Y. Li, et al., 2021: Multistage Extraction of Star Anise and Black Pepper Derivatives for Antibacterial, Antioxidant, and Anticancer Activity. Front. Chem. 9(May), 1–14. doi: 10.3389/fchem.2021.660138.
Liu, H., Q. Li, Y. Zhang, & Y. Zhou, 2009: Analysis of (-)-shikimic acid in Chinese star anise by GC-MS with selected ion monitoring. Chromatographia 69(3–4), 339–344. doi: 10.1365/s10337-008-0898-6.
Lizogub, V.G., D.S. Riley, & M. Heger, 2007: Efficacy of a Pelargonium Sidoides Preparation in Patients With the Common Cold: A Randomized, Double Blind, Placebo-Controlled Clinical Trial. Explor. J. Sci. Heal. 3(6), 573–584. doi: 10.1016/j.explore.2007.09.004.
Luna, L.A., A.L.L. Bachi, R.R. Novaes E Brito, R.G. Eid, V.M. Suguri, et al., 2011: Immune responses induced by Pelargonium sidoides extract in serum and nasal mucosa of athletes after exhaustive exercise: Modulation of secretory IgA, IL-6 and IL-15. Phytomedicine 18(4), 303–308. doi: 10.1016/j.phymed.2010.08.003.
- Estevez, A., & R. J. Estevez, 2012: A Short Overview on the Medicinal Chemistry of (—)-Shikimic Acid. Mini-Reviews Med. Chem. 12, 1443–1454. doi: 10.2174/138955712803832735.
Ma, X., & S. Ning, 2019: Shikimic acid promotes estrogen receptor(ER)-positive breast cancer cells proliferation via activation of NF-κB signaling. Toxicol. Lett. 312, 65–71. doi: 10.1016/j.toxlet.2019.04.030.
Macknin, M., K. Wolski, J. Negrey, & S. Mace, 2020: Elderberry Extract Outpatient Influenza Treatment for Emergency Room Patients Ages 5 and Above: a Randomized, Double-Blind, Placebo-Controlled Trial. J. Gen. Intern. Med. 35(11), 3271–3277. doi: 10.1007/s11606-020-06170-w.
Mahboubi, M., 2020: Sambucus nigra (black elder) as alternative treatment for cold and flu. Adv. Tradit. Med., 405–414. doi: 10.1007/s13596-020-00469-z.
Martin, D., M. Konrad, C.C. Adarkwah, & K. Kostev, 2020: Reduced antibiotic use after initial treatment of acute respiratory infections with phytopharmaceuticals- a retrospective cohort study. Postgrad. Med. 132(5), 412–418. doi: 10.1080/00325481.2020.1751497.
Matthys, H., V.G. Lizogub, F.A. Malek, & M. Kieser, 2010: Efficacy and tolerability of EPs 7630 tablets in patients with acute bronchitis: A randomised, double-blind, placebo-controlled dose-finding study with a herbal drug preparation from Pelargonium sidoides. Curr. Med. Res. Opin. 26(6), 1413–1422. doi: 10.1185/03007991003798463.
Młynarczyk, K., D. Walkowiak-Tomczak, & G.P. Łysiak, 2017: Bioactive properties of Sambucus nigra L. as a functional ingredient for food and pharmaceutical industry. J. Funct. Foods 40, 377–390. doi: 10.1016/j.jff.2017.11.025.
Murkovic, M., P.M. Abuja, A.R. Bergmann, A. Zirngast, U. Adam, et al., 2004: Effects of elderberry juice on fasting and postprandial serum lipids and low-density lipoprotein oxidation in healthy volunteers: A randomized, double-blind, placebo-controlled study. Eur. J. Clin. Nutr. 58(2), 244–249. doi: 10.1038/sj.ejcn.1601773.
Olejnik, A., M. Olkowicz, K. Kowalska, J. Rychlik, R. Dembczyński, et al., 2016: Gastrointestinal digested Sambucus nigra L. fruit extract protects in vitro cultured human colon cells against oxidative stress. Food Chem. 197, 648–657. doi: 10.1016/j.foodchem.2015.11.017.
Papies, J., J. Emanuel, N. Heinemann, Ž. Kulić, S. Schroeder, et al., 2021: Antiviral and Immunomodulatory Effects of Pelargonium sidoides DC. Root Extract EPs® 7630 in SARS-CoV-2-Infected Human Lung Cells. Front. Pharmacol. 12(October), 1–19. doi: 10.3389/fphar.2021.757666.
Patra, J.K., G. Das, S. Bose, S. Banerjee, C.N. Vishnuprasad, et al., 2020: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. Phyther. Res. 34(6), 1–20. doi: 10.1002/ptr.6614.
Payne, R., & M. Edmonds, 2005: Isolation of shikimic acid from star aniseed. J. Chem. Educ. 82(4), 599–600. doi: 10.1021/ed082p599.
Perić, A., D. Gaćeša, A. Barać, J. Sotirović, & A. V. Perić, 2020: Herbal Drug EPs 7630 versus Amoxicillin in Patients with Uncomplicated Acute Bacterial Rhinosinusitis: A Randomized, Open-Label Study. Ann. Otol. Rhinol. Laryngol. 129(10), 969–976. doi: 10.1177/0003489420918266.
Porter, R.S., & R.F. Bode, 2017: A Review of the Antiviral Properties of Black Elder (Sambucus nigra L.) Products. Phyther. Res. 31(4), 533–554. doi: 10.1002/ptr.5782.
Przybylska-Balcerek, A., T. Szablewski, L. Szwajkowska-Michałek, D. Świerk, R. Cegielska-Radziejewska, et al., 2021: Sambucus nigra extracts–natural antioxidants and antimicrobial compounds. Molecules 26(10), 1–17. doi: 10.3390/molecules26102910.
Pschyrembel Online., 2018: Artikel Illicium verum Hook f. https://www.pschyrembel.de/illicium verum/H07BR/doc/ (accessed 11 February 2022).
Pschyrembel Online, 2016: Illicium anisatum L. Hunnius Pharm. https://www.pschyrembel.de/Illicium anisatum/H07BQ/doc/ (accessed 11 February 2022).
Qualitätsgeflügelvereinigung, Q.-Ö., 2022: ILT Infektiöse Laryngotracheitis. https://www.qgv.at/veterinaer/ilt-infektioese-laryngotracheitis/ (accessed 31 March 2022).
Rabelo, T.K., A.G. Guimarães, M.A. Oliveira, J. Gasparotto, M.R. Serafini, et al., 2016: Shikimic acid inhibits LPS-induced cellular pro-inflammatory cytokines and attenuates mechanical hyperalgesia in mice. Int. Immunopharmacol. 39, 97–105. doi: 10.1016/j.intimp.2016.07.016.
Rahman, R.T., Z. Lou, J. Zhang, F. Yu, Y.P. Timilsena, et al., 2017: Star Anise (Illicium verum Hook. F.) As Quorum Sensing and Biofilm Formation Inhibitor on Foodborne Bacteria: Study in Milk. J. Food Prot. 80(4), 645–653. doi: 10.4315/0362-028X.JFP-16-294.
Rauš, K., S. Pleschka, P. Klein, R. Schoop, & P. Fisher, 2015: Effect of an Echinacea-Based Hot Drink Versus Oseltamivir in Influenza Treatment: A Randomized, Double-Blind, Double-Dummy, Multicenter, Noninferiority Clinical Trial. Curr. Ther. Res. – Clin. Exp. 77, 66–72. doi: 10.1016/j.curtheres.2015.04.001.
Roschek, B., R.C. Fink, M.D. McMichael, D. Li, & R.S. Alberte, 2009: Elderberry flavonoids bind to and prevent H1N1 infection in vitro. Phytochemistry 70(10), 1255–1261. doi: 10.1016/j.phytochem.2009.06.003.
Salvador, Â.C., E. Król, V.C. Lemos, S.A.O. Santos, F.P.M.S. Bento, et al., 2017: Effect of elderberry (Sambucus nigra L.) extract supplementation in STZ-induced diabetic rats fed with a high-fat diet. Int. J. Mol. Sci. 18(1). doi: 10.3390/ijms18010013.
Saraswathi, J., K. Venkatesh, N. Baburao, M.H. Hilal, & A.R. Rani, 2011: Phytopharmacological importance of pelargonium species. J. Med. Plants Res. 5(13), 2587–2598. https://academicjournals.org/journal/JMPR/article-full-text-pdf/054149D15942 (accessed 13 January 2022).
Sato, Y., S. Itagaki, T. Kurokawa, J. Ogura, M. Kobayashi, et al., 2011: In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid. Int. J. Pharm. 403(1–2), 136–138. doi: 10.1016/j.ijpharm.2010.09.035.
Schapowal, A., P. Klein, & S.L. Johnston, 2015: Echinacea Reduces the Risk of Recurrent Respiratory Tract Infections and Complications: A Meta-Analysis of Randomized Controlled Trials. Adv. Ther. 32(3), 187–200. doi: 10.1007/s12325-015-0194-4.
Seifert, G., J. Brandes-Schramm, A. Zimmermann, W. Lehmacher, & W. Kamin, 2019: Faster recovery and reduced paracetamol use – A meta-analysis of EPs 7630 in children with acute respiratory tract infections. BMC Pediatr. 19(1), 1–11. doi: 10.1186/s12887-019-1473-z.
Sharifi-Rad, M., D. Mnayer, M.F.B. Morais-Braga, J.N.P. Carneiro, C.F. Bezerra, et al., 2018: Echinacea plants as antioxidant and antibacterial agents: From traditional medicine to biotechnological applications. Phyther. Res., 1–11. doi: 10.1002/ptr.6101.
Sharma, M., S.A. Anderson, R. Schoop, & J.B. Hudson, 2009: Induction of multiple pro-inflammatory cytokines by respiratory viruses and reversal by standardized Echinacea, a potent antiviral herbal extract. Antiviral Res. 83(2), 165–170. doi: 10.1016/j.antiviral.2009.04.009.
Sharma, S.M., M. Anderson, S.R. Schoop, & J.B. Hudson, 2010: Bactericidal and anti-inflammatory properties of a standardized Echinacea extract (Echinaforce®): Dual actions against respiratory bacteria. Phytomedicine 17(8–9), 563–568. doi: 10.1016/j.phymed.2009.10.022.
Signer, J., H.R. Jonsdottir, W.C. Albrich, M. Strasser, R. Züst, et al., 2020: In vitro virucidal activity of Echinaforce®, an Echinacea purpurea preparation, against coronaviruses, including common cold coronavirus 229E and SARS-CoV-2. Virol. J. 17(1), 1–11. doi: 10.1186/s12985-020-01439-2.
Tahan, F., & M. Yaman, 2013: Can the Pelargonium sidoides root extract EPs® 7630 prevent asthma attacks during viral infections of the upper respiratory tract in children? Phytomedicine 20(2), 148–150. doi: 10.1016/j.phymed.2012.09.022.
Tiralongo, E., S.S. Wee, & R.A. Lea, 2016: Elderberry supplementation reduces cold duration and symptoms in air-travellers: A randomized, double-blind placebo-controlled clinical trial. Nutrients 8(182), 1–15. doi: 10.3390/nu8040182.
Ulbricht, C., E. Basch, L. Cheung, H. Goldberg, P. Hammerness, et al., 2014: An evidence-based systematic review of elderberry and elderflower (Sambucus nigra) by the natural standard research collaboration. J. Diet. Suppl. 11(1), 80–120. doi: 10.3109/19390211.2013.859852.
della Volpe, A., G. Ricci, M. Ralli, V. Gambacorta, A.D.E. Lucia, et al., 2019: The effects of oral supplements with Sambucus nigra, Zinc, Tyndallized Lactobacillus acidophilus (H122), Arabinogalactans, Vitamin D, vitamin E and Vitamin C in otitis media with effusion in children: A randomized controlled trial. Eur. Rev. Med. Pharmacol. Sci. 23(14), 6360–6370. doi: 10.26355/eurrev_201907_18460.
Wacker, A., & W. Hilbig, 1978: Virushemmung mit Echinacea purpurea. J. Med. Plant Res. 33(1), 89–102. doi: 10.1055/s-0028-1097364.
Wang, G.W., W.T. Hu, B.K. Huang, & L.P. Qin, 2011: Illicium verum: A review on its botany, traditional use, chemistry and pharmacology. J. Ethnopharmacol. 136, 10–20. doi: 10.1016/j.jep.2011.04.051.
Weng, J.R., C.S. Lin, H.C. Lai, Y.P. Lin, C.Y. Wang, et al., 2019: Antiviral activity of Sambucus FormosanaNakai ethanol extract and related phenolic acid constituents against human coronavirus NL63. Virus Res. 273(September), 1–8. doi: 10.1016/j.virusres.2019.197767.
Wichtl, M., & W. Blaschek, 2016: Wichtl – Teedrogen und Phytopharmaka: ein Handbuch für die Praxis. 6. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart.
Woelkart, K., & R. Bauer, 2007: The role of alkamides as an active principle of Echinacea. Planta Med. 73(7), 1–9. doi: 10.1055/s-2007-981531.
Woelkart, K., E. Marth, A. Suter, R. Schoop, R.B. Raggam, et al., 2006: Bioavailability and pharmacokonetica of Echinacea purpurea preparations and their interaction with the immune system. Int. J. Clin. Pharmacol. Ther. 44(9), 401–408. doi: 10.5414/cpp44401.
Yale, Steven H., M., & P. Liu, Kerjian, 2004: Echinacea purpurea Therapy for the Treatment of the Common Cold. Arch Intern Med 164, 1237–1241. doi: 10.1001/archinte.164.11.1237.
Zakay-Rones, Z., E. Thom, T. Wollan, & J. Wadstein, 2004: Randomized study of the efficacy and safety of oral elderberry extract in the treatment of influenza A and B virus infections. J. Int. Med. Res. 32(2), 132–140. doi: 10.1177/147323000403200205.
Zakay-Rones, Z., N. Varsano, M. Zlotnik, O. Manor, L. Regev, et al., 1995: Inhibition of Several Strains of Influenza Virus in Vitro and Reduction of Symptoms by an Elderberry Extract (Sambucus nigra L.) during an Outbreak of Influenza B Panama. J. Altern. Complement. Med. 1(4), 361–369. doi: 10.1089/acm.1995.1.361.
Von den etwa 250 Pelargoniumarten, u. a. P. sidoides, findet man etwa 80 % in Südafrika. In ihrem Ursprungsland kommt die Pflanze in Höhenlagen bis zu 2300 m, aber auch in küstennahen Gebieten vor. Im Gegensatz zu P. reniforme, die eher in letzterem Gebiet wächst, bevorzugt P. sidoides eher höhere Lagen (Saraswathi et al., 2011).
Pelargonium sidoides wächst als Kleinstrauch mit einer Höhe bis zu 80 cm und kurzem Stängel. Die Blätter sind rosettenartig abgezweigt und bei P. sidoides meist groß, herzförmig, an der Spitze abgerundet sowie langstielig und mit fein gelapptem Rand. Durch kleine Drüsenhaare, die das Blatt stark überziehen, fühlt es sich samtig an. Die Nebenblätter können als 0,3 cm breit und 1–2 cm lang beschrieben werden. Die Blattformen können je nach Art von herz- bis nierenförmig variieren.
Um in Dürrezeiten oder bei Bränden besser überleben zu können, besitzt die Pflanze ein ausgeprägtes Wurzelsystem, das sich in kurze, knollige und lange unverdickte Abschnitte gliedert und einen Durchmesser von 1–3,5 cm hat. Die Blütenfarbe kann von hellrot bis dunkel lilaschwarz reichen.
Durch die steigende Gefahr der Ausrottung und Wildsammlung wird die Pflanze zur Herstellung von Phytopharmaka aus Kulturanbauten bezogen. Die Vermehrung findet hier über Stecklinge oder Samen statt. Nach dreijähriger Kultivierung wird die Pflanze schließlich per Hand geerntet (Wichtl & Blaschek, 2016).
Droge
Verwendet werden die ungeschälten, trockenen unterirdischen Organe von Pelargonium sidoides DC oder Pelargonium reniforme CURT. Vorgeschrieben ist ein Mindestgehalt an Tanninen von mind. 2,0 %, berechnet als Pyrogallol (Escop, 2015).
Die pflanzlichen Präparate, die als „well-established-use“ eingetragen sind, werden in erster Linie als wässrig-ethanolische Extrakte der Wurzeln von Pelargonium sidoides zubereitet. Traditionell werden auch Dekokte und Aufgüsse bereitet, zu denen es aber keine genauen Angaben bezüglich der eingesetzten Rohdroge gibt (Brendler & van Wyk, 2008; Ema/Hmpc, 2011).
Wichtige Bestandteile sind vor allem Cumarine und Gerbstoffe. Letztere liegen mit einem Gehalt von etwa 9 % vor. Laut Ph. Eur. ist ein Mindestgehalt von 2 % Tanninen berechnet als Pyrogallol festgelegt (Wichtl & Blaschek, 2016).
Die Wurzeln der Pelargonien enthalten neben oligomeren und polymeren Proanthocyanidinen auch kondensierte Gerbstoffe aus monomeren Flavan-3-ol-Bausteinen wie Catechin, Gallocatechin und Afzelechin. Ebenso findet man Phenolsäuren wie die Gallussäure und seine Methylester und Hydroxyzimtsäuren (Kaffeesäure, p-Cumarsäure).
Typisch für die Pelargoniumarten ist der hohe Oxygenierungsgrad der Cumarine (in P. sidoides etwa 0,05 % und in P. reniforme etwa 0,03 %). So findet man viele Cumarinderivate wie etwa Scopoletin (6-Hydroxy-7-methoxycumarin), TMC (5,6,7-Trimethoxycoumarin), 5,6,7,8-Tetramethoxycumarin und DHDMC (6,8-Dihydroxy-5,7-dimethoxycumarin) die alle für P. sidoides charakteristisch sind (Escop, 2015). Weiters findet man noch das Umckalin-7-b-glucosid und das 5,6-Dimethoxycumarin-7-sulfat in P. sidoides (Ema/Hmpc, 2011).
Als Leitstruktur für P. sidoides kann Umckalin (7-Hydroxy-5,6-dimethoxycumarin) und sein 7-O-Methylether bezeichnet werden, da sie nur in P. sidoides vorkommen (Wichtl & Blaschek, 2016).
Außerdem findet man noch 8-Hydroxy-5,6,7-trimethoxycumarin und 6,7,8,-Trihydroxycumarin, die in beiden Pelargonium-Arten zu finden sind (Escop, 2015).
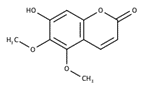
Abb. 1: Strukturformel Umckalin
In europäischen Ländern sind Pelargonien vor allem dekorativ in Verwendung. So zieren sie so manchen Balkon oder manches Fensterbrett und man erfreut sich ihres Anblickes. Verschiedene Pelargoniumarten haben ihren Ursprung in Südafrika und werden dort, aufgrund ihrer heilenden und gesundheitsfördernden Eigenschaften, in langer Tradition von Heilern eingesetzt. Umckaloabo etwa ist ein traditionelles pflanzliches Mittel aus Pelargonium sidoides und Pelargonium reniforme und wird traditionell bei Leberbeschwerden und Dysmenorrhoe eingesetzt (Ema/Hmpc, 2011).
Traditionell wurden die Wurzeln und das Kraut von P. sidoides außerdem noch gegen Malaria, Entzündungen sowie Beschwerden im Abdominalbereich und Uterus verwendet. Zusätzlich wurde die Pflanze noch in Abkochungen verwendet, um an Fieber Erkrankte damit zu waschen. In gepulverter Form wurde sie unter das Essen gemischt oder aber auch in ihrer ganzen Form gekaut. Eine weitere Zubereitungsart war das Kochen der Pelargoniumknolle in Milch (Saraswathi et al., 2011).
Die Blätter von P. sidoides wurden äußerlich zur Wundbehandlung, gegen Abszesse, zur Behandlung von Neuralgien und Halsinfektionen sowie auch bei diversen Hauterkrankungen verwendet. Innerlich wurde die Pflanze als blutstillendes Mittel, etwa bei Menorrhagie, Hämorrhoiden, Syphilis und Magengeschwüren, verwendet. Paracelsus schrieb der Pflanze kardiotonische und antidepressive Eigenschaften zu und empfahl sie als Spülung bei Leukorrhoe. Die gekochten Blätter wurden ebenso zur Wundbehandlung gegen Madenbefall verwendet (Saraswathi et al., 2011).
Zudem wurde P. sidoides traditionell in manchen südafrikanischen Regionen bei mit Würmern befallenen Kälbern eingesetzt. Zusätzlich gibt es noch die Verwendung der Pflanze gegen Durchfall bei Pferden und zur Behandlung von Lebererkrankungen bei Schafen und Kälbern (Saraswathi et al., 2011).
Nach Europa bzw. England kam Umckaloabo erstmals im 19. Jahrhundert durch den Briten Charles Henry Stevens. Dieser vertraute der traditionellen Medizin aus Südafrika und speziell der Pelargonium-Pflanze, die er bei Tuberkulose einsetzte. Stevens verwendete den Namen Umckaloabo, um die außergewöhnlichen Wurzeln der Pelargonium-Pflanze zu beschrieben. Das Wort selbst lässt sich von den Bezeichnungen für Brustschmerzen und Symptomen von Lungenkrankheiten in Zulu ableiten. Unter dem Namen „Stevens’ Consumption Cure“ produzierte und vertrieb Stevens in England das Präparat, das zunächst in Pulverform, eingerührt in Wasser, und anschließend auch als mit Alkohol und Glycerin versetzte Flüssigkeit verkauft wurde. In den letzten Jahren wurden mehrere Untersuchungen chromatografischer und botanischer Natur an Umckaloabo durchgeführt. Dabei konnten P. sidoides und P. reniforme nachgewiesen werden. Traditionelle Aufgüsse von P. sidoides und P. reniforme werden gegen Tuberkulose und gastrointestinale Beschweren wie etwa Durchfall und Ruhr verwendet (Ema/Hmpc, 2011).
Verwendet werden die Extrakte von P. sidoides bei Erkrankungen und Infektionen der oberen Atemwege sowie bei Erkältungen. Ebenso bei Erkältungserscheinungen wie etwa einer rinnenden Nase, Husten oder Halsschmerzen (Escop, 2015).
Speziell gegen Erkrankungen der oberen Atemwege wie etwa Bronchitis, Tonsillopharyngitis, Sinusitis und allgemeine Erkältungen konnte für das Extrakt von P. sidoides eine gute Wirksamkeit und vor allem eine sichere Anwendung nachgewiesen werden, welche in klinischen Studien bei mit Bronchitis erkrankten PatientInnen bestätigt werden konnte. Klinische Untersuchungen mit EPs 7630 zeigten eine deutliche Reduktion der Stärke und Dauer bei akuten Atemwegserkrankungen. P. sidoides-Präparate stellen somit eine gute Alternative zur Antibiotikatherapie in der Behandlung oben genannter Atemwegserkrankungen bei Kleinkindern und Erwachsenen dar.
Allgemein werden Pelargonium-Arten gerne auch zur Behandlung von Kinderkrankheiten wie Masern, Mumps oder Windpocken verwendet. Ebenso werden sie u. a. bei Herpes, Gürtelrose, Ekzemen und trockener Haut herangezogen (Saraswathi et al., 2011)
Die Dosierung lag laut klinischen Studien für Erwachsene bei dreimal täglich 30 Tropfen eines Flüssigpräparats. Bei diesen flüssigen Zubereitungen beinhalteten 10 g Flüssigkeit 8 g eines 11 % m/m Ethanolextrakts der P.-sidoides-Wurzel (DER 1:8-10).
Bei Kindern ist die Dosierung laut verschiedenen klinischen Studien wie folgt: Kinder unter zwei Jahren bekommen 3 x 5 Tropfen täglich, zwischen 2 und 6 Jahren werden 3 x 10 Tropfen und bei Kindern zwischen 6 und 12 Jahren 3 x 20 Tropfen gegeben. Andere Studien verabreichten Kindern zwischen 1 und 6 Jahren auch 3 x 10 Tropfen.
Laut Packungsbeilagen werden für Erwachsene 3 x 30 Tropfen oder 3 x 1 Tablette und für Kinder von 6 bis 12 Jahren eine Dosierung von 3 x 20 Tropfen oder 2 x 1 Tablette empfohlen. In den Tabletten sind je 20 mg an Pelargonium sidoides-Ethanolextrakt enthalten. Die Menge der äquivalenten Flüssigkeitsmenge sowie die Tablettenform wurde aber nicht angegeben.
In Deutschland gibt es die gleichen Zubereitungen, Darreichungsformen und Dosierungen wie in Österreich. Die Indikation bezieht sich lediglich konkret auf die Behandlung von akuter Bronchitis und ihrer akuten Symptomatik (Ema/Hmpc, 2011).
Unerwünschte Nebenwirkungen
Als Nebenwirkungen konnten gastrointestinale Beschwerden wie etwa Durchfall, Übelkeit und Erbrechen sowie allergische Hautreaktionen beobachtet werden, zudem noch leichtes Nasen- und Zahnfleischbluten. Allerdings wurden in einigen Fällen auch Hepatoxizität und Hepatitis vermerkt. Beim Auftreten dieser Begleiterscheinungen ist die Einnahme unverzüglich abzubrechen und ein Arzt aufzusuchen. Allgemein gilt die Anwendung von Pelargonium-Präparaten in den angewendeten Dosierungen als sicher (Ema/Hmpc, 2018).
Toxikologie
Mit einer 1:10-Tinktur (Ethanol 9-11 % m/ m) von Pelargonium-sidoides-Wurzeln wurde eine Zytotoxizitäts-Studie durchgeführt. Das Ergebnis brachte für die humanen Blut- und Leberzellen im Zellviabilitäts- und Membranintegritäts-Test keine zytotoxischen Effekte innerhalb der getesteten Konzentrationen von 30, 100, 300 und 1000 mg/ml. Eine leichte Reduktion der Zellviabilität um 20 %, allerdings nur in der höchsten eingesetzten Konzentration, konnte in den Leberzellen (HepG2) beobachtet werden. Im Membranintegritäts-Test konnten ebenso keine zytotoxischen Effekte festgestellt werden.
Im einem weiteren durchgeführten Bioassay (brine shrimp lethality bioassay) zeigten weder die Pelargonium-Extrakte noch deren phenolische Komponenten (inkl. Benzoesäure- und Zimtsäure-Derivate), hydrolysierbare Tannine und C-Glykosylflavone, zytotoxische Effekte. Im Vergleich zu den Vergleichssubstanzen Actinomycin und Podophyllotoxin, mit einer LC50 von je 0,53 mg/ ml bzw. 72 mg/ ml, waren die LC50-Werte von >1000 mg/ ml und >200 mg/ ml für die ethanolisch-wässrigen Pelargoniumextrakte und einzelne Komponenten nahezu unbedeutend.
Zusätzlich wurden noch einige Tierstudien zu einzelnen Inhaltsstoffen von Pelargoniumextrakten durchgeführt. So wurde die Sicherheit der Gallussäure an Mäusen getestet. Trotz hoch angewendeter Dosen von 5 g/kg Körpergewicht konnte keine Toxizität oder Mortalität beobachtet werden. Ebenso konnte bei einer Dosis von 1000 mg/kg Körpergewicht über 28 Tage keine Erhöhung der hämatologischen Parameter festgestellt werden. Auch blieben die Werte von SGOT und SGPT, ebenso wie einige Serumbestandteile wie etwa Plasmaprotein, Cholesterol, Urea und Bilirubin, ohne nennenswerte Veränderung.
Bei der Prüfung der Lebertoxizität von Extrakten aus den Wurzeln von P. sidoides wurde beim Versuch an Hunden und Ratten nach der Gabe von bis zu 3000 mg/kg EPs 7630 keine Schädigung der Leberzellen sichtbar. Keine Änderungen waren außerdem in Bezug auf die Transaminase, Lactat-Dehydrogenase und Alkaline-Phosphatase-Aktivität und den Bilirubinlevel zu sehen (Ema/Hmpc, 2011).
Anwendungsbeschränkungen
In Bezug auf Schwangerschaft und Stillzeit oder Beeinträchtigung der Fahrtüchtigkeit liegen zurzeit keine Daten vor.
Allgemein wird Schwangeren und stillenden Müttern von der Einnahme von Pelargonium-Präparaten allerdings abgeraten (Escop, 2015).
Allgemein sollten Präparate aus P. sidoides oder auch P. reniforme nicht bei einer bestehenden Allergie oder Hypersensibilität gegenüber einem oder mehreren Inhaltsstoffen bzw. der Pflanze selbst angewendet werden.
Ebenso ist für die Anwendung von Kindern unter 6 Jahren die Datenlage noch zu gering, um eine ausreichende Sicherheit zu gewährleisten (Ema/Hmpc, 2018).
Wechselwirkungen
Es gibt keine Daten zu etwaigen Wechselwirkungen (Ema/Hmpc, 2018).
In einer Studie wurde die mögliche Interaktion von Penicillin V mit EPs® 7630 untersucht. Dazu wurden 28 gesunde ProbandInnen aufgefordert, über sieben Tage 3 x 1 Tablette des Penicillin-V-Präparates (Isocillin®) entweder alleine oder in Kombination mit EPs® 7630 einzunehmen. Am Ende wurden die pharmakokinetischen Parameter, AUC und die maximale Penicillinkonzentration im Plasma, von Penicillin V am Tag 0 und Tag 7, verglichen. Das Ergebnis zeigte allerdings keine signifikanten Unterschiede zwischen den zwei Behandlungsgruppen (mit oder ohne EPs®-7630-Behandlung). Ebenso konnte nachgewiesen werden, dass Pelargonium-Präparate weder die Koagulation noch die Antikoagulation des Blutes beeinflussen (Ema/Hmpc, 2011).
Antibakterielle Wirksamkeit
An isolierten Inhaltsstoffen von P. sidoides und P. reniforme wurde die antibakterielle Wirkung gegen acht Mikroorganismen inklusive gramnegativer und grampositiver Bakterien überprüft. Diese isolierten Inhaltsstoffe waren: Scopoletin, Gallussäure mit ihren Methylestern, Umckalin, 5,6,7-Trimethoxycumarin, 6,8-Dihydroxy-5-7-dimethoxycomarin und (+)-Catechin. Die antibakterielle Wirkung wurde mittels der „agar-dilution-method“ ermittelt.
Die eingesetzten Pathogene waren u. a. E. coli, Staphylococcus aureus und S. pneumoniae sowie Klebsiella pneumoniae, die gewählt wurden, da sie oft für Atemwegsinfektionen verantwortlich sind und diese auslösen.
Die Rohextrakte der Pelargonium-Arten zeigten eine moderate Wirkung gegen die eingesetzten Bakterien. Für alle getesteten Inhaltsstoffe außer (+)-Katechin konnte eine antibakterielle Wirkung ermittelt werden. So reichte die MIC von 0,6 mg/ml für wässrige Wurzelextrakte, bis zu 10 mg/ml für Rohextrakte (Wurzel und Blätter). Als Vergleichssubstanzen wurden hier Penicillin G und Erythromycin eingesetzt, mit einer MIC von 5–166 mg/ml bzw. 2–125 mg/ml. Die beste Wirkung erzielten Umckalin und 6,8-Dihydroxy-5,7-dimethoxycumarin mit MICs von 200-500 mg/ml. Beide konnten im wässrigen Wurzelextrakt von Pelargonium sidoides nachgewiesen werden, das auch das Extrakt mit der höchsten Wirkung darstellte (Kayser & Kolodziej, 1997).
In weiteren Untersuchungen wurden auch die Aceton- und Methanolextrakte von P. sidoides auf ihre antimikrobielle Aktivität gegen zehn Bakterien und fünf Pilze getestet. Zum Einsatz kam die Dilutionsmethode auf einem festen Agarmedium. Die zehn eingesetzten Bakterien waren je fünf grampositve (Bacillus cereus, Staphylococcus epridermis, Staphylococcus aureus, Micrococcus kristinae, Streptococcus pyogenes) und fünf gramnegative (Escherichia coli, Salmonella pooni, Serratia marcescens, Pseudomonas aeruginosa und Klebsiella pneumoniae). Für alle grampositive Bakterien außer Staphylococcus epidermidis konnte für das Methanol- und Acetonextrakt eine antibakterielle Wirkung nachgewiesen werden. Die MIC reichte hier von 1 bis 5 mg/ml mit Ausnahme des Acetonextrakts gegen Klebsiella pneumoniae, wo die MIC 10 mg/ml betrug. Aufschlussreich war vor allem die hemmende Wirkung gegen Bacillus cereus und Klebsiella pneumoniae, da diese zwei Pathogene darstellen, die mit Infektionen der Atemwege bzw. Erkältungen und Grippe im Zusammenhang stehen. Für drei der gramnegativen Bakterien (Escherichia coli, Serratia marcescens und Pseudomonias aeruginosa) konnte selbst bei der höchsten eingesetzten Konzentration von 10 mg/ml keine Inhibierung beobachtet werden.
Aufgrund früherer Erkenntnisse und des Wissens, dass wässrige Extrakte von Pflanzen keine antimikrobiellen Eigenschaften besitzen, wurden hier Aceton- und Methanolextrakte verwendet. In früheren Untersuchungen wurde bereits von einer erhöhten Resistenz der gramnegativen Bakterien gegenüber Pflanzenextrakten berichtet. Dies konnte in dieser Studie nur bestätigt werden (Lewu et al., 2006).
Ein Vergleich zwischen den Trieben und Wurzeln von Pelargonium sidoides zeigte, dass es bezüglich der MIC-Werte zwischen den beiden keine großen Unterschiede gibt. Die antibakterielle Aktivität ist somit in beiden Pflanzenteilen in ähnlichem Ausmaß vorhanden. Ebenso zeigte sich eine ähnliche Bioaktivität der Pflanzenteile unterschiedlicher Pelargonium-Arten. Gramnegative Bakterien konnten allerdings mit dem Wurzel- bzw. Blätterextrakt kaum oder gar nicht inhibiert werden.
Auch gegen das Extrakt EPs® 7630 konnte eine gute antibakterielle Aktivität und sogar Wirksamkeit gegen multiresistente Stämme von S. aureus (MIC 3,3 mg/ml) festgestellt werden.
Zusätzlich wurde noch der Einfluss von EPs® 7630 gegenüber der Aktivität von humanen peripheren Blutphagozyten (PBP) und der Interaktion mit Wirtsbakterien in vitro getestet (Conrad et al., 2007). EPs® 7630 wurde dabei in therapeutischen Dosen zwischen 0–30 mg/ml eingesetzt. Gemessen wurde neben der Aktivität zur Phagozytose ebenso der oxidative Burst, die Adhäsion von Streptokokken der Gruppe A (GAS) an menschlichen Hep-2- und bukkalen Epithelzellen (BEC) (Conrad & Frank, 2008) sowie die intrazelluläre Abtötung. Eine Erhöhung der phagozytierenden PBPs und intrazellulären Abtötungen durch EPs® 7630 konnte konzentrationsabhängig gezeigt werden (Conrad et al., 2007). In weiteren Untersuchungen, bei denen GAS als Testorganismus und Hep-2- sowie BEC-Zellen als Substrat verwendet wurden, zeigte sich eine dosisabhängige Reduktion der GAS-Adhäsion an die Hep-2-Zellen, aber eine Steigerung der Adhäsion von GAS an BEC-Zellen durch EPs® 7630. So konnte gezeigt werden, dass die Anheftung von Bakterien an die Hep-2 Zellen reduziert wird, zum anderen allerdings Krankheitserreger durch eine verstärkte Bakterienadhäsion an die BEC-Zellen gefangen und inaktiviert werden können (Conrad & Frank, 2008). Dies bedeutet, dass die Krankheitserreger bei Husten freigesetzt werden und durch das Schlucken möglicherweise inaktiviert werden (Ema/Hmpc, 2011).
Trotz der nachgewiesenen antibakteriellen und antifungiziden Wirkung kann die klinische Wirkung von Pelargoniumpräparaten, in Bezug auf die Behandlung von Atemwegsinfektionen nicht vollständig erklärt werden. Man vermutet die antiinfektiöse Wirkung auch wegen eines Zusammenspiels zwischen den Krankheitserregern und den Epithelzellen (Ema/Hmpc, 2011).
Für Helicobacter pylori konnte eine Wachstumshemmung von 43 % mit einem ethanolischen Extrakt aus P. sidoides (100 mg/ml) erzielt werden. Beide eingesetzten Extraktkonzentrationen (50 und 100 mg/ml) reduzierten die Menge der Bakterien, die sich an die Magenschleimhaut anhefteten um je 77 % bzw. 91 %. Die Vergleichssubstanz Amoxicillin zeigte hingegen keinerlei Aktivität (Escop, 2015).
Antimikrobielle Wirkung
Antituberkulöse Aktivität
Wegen der traditionellen Verwendung bei Tuberkulose wurde an verschiedenen Pelargonium-Extrakten die antimikrobielle Wirkung überprüft.
Gegenüber Mycobacterium tubercolosis zeigte das Extrakt von P. sidoides, in einem Radiorespirometrie Assay, bei einer Konzentration von 12,5 mg/ml eine hemmende Wirkung. Das Extrakt von P. reniforme hingegen zeigte keinerlei Wirkung. Ebenso zeigten keine der isolierten Inhaltsstoffe (Phenole und Cumarine) eine antimikrobielle Wirkung. Eine Aktivität gegen M. tuberculosis konnte für das P.-sidoides-Extrakt (MIC 100 µg/ml) mittels Alamar Blue Assay gezeigt werden. Als Vergleichssubstanz wurde Rifampicin, mit einer MIC von 0,06 µg/ml verwendet.
Bei den Hexan-Extrakten der Wurzeln von P. sidoides und P. reniforme zeigte die isolierte Öl- und Linolsäure eine antimikrobielle Wirksamkeit gegen M. areum und M. smegmatis mit einem MIC von 2 mg/l. Die Vergleichssubstanz Isoniazid wies eine MIC von 0,06–1 mg/l auf.
Verschiedene weitere Extrakte und isolierte Inhaltsstoffe aus den Wurzeln von Pelargoniumarten wurden gegen M. tuberculosis getestet, wobei nur die Aceton-, Chloroform- und Ethanolextrakte von P. reniforme mit einer MIC von etwa 5000 mg/l geringe Aktivität aufwiesen. Rifampicin als Vergleichssubstanz kam auf eine MIC von 0,2 mg/l. Von den isolierten Inhaltsstoffen und den Extrakten konnte somit keines überzeugen.
Gegen die obligatorischen pathogenen Myobacterium aurum und M. smegmatis konnte mit wässrigen Acetonextrakten aus Wurzel-, Pflanzenteilen und Fraktionen von P. sidoides keine erwähnenswerten antimikrobiellen Ergebnisse erzielt werden.
Nachgewiesen werden konnte zudem für das wässrige Wurzelextrakt von P. reniforme eine Stimulierung der Makrophagentötung von M. tuberculosis. In der Wasserfraktion wurden die Gallussäure sowie Methylgallat als die bioaktivsten Komponenten identifiziert.
Festgestellt werden konnte außerdem, dass mit EPs® 7630 vorbehandelte humane PBPs zu einer eindeutigen Reduktion der überlebenden Candida–albicans-Organismen führen. Vermutet wird diese Wirkung wegen erhöhter Phagozyten-Aktivität durch EPs® 7630, da für das Extrakt keine direkte antimykotische Aktivität nachgewiesen werden konnte (Ema/Hmpc, 2011).
Antimykotische Aktivität
Wie oben bereits erwähnt, wurde 2006 (Lewu et al., 2006) in einer Studie die Wirksamkeit von Methanol- bzw. Acetonextrakten von P. sidoides gegenüber fünf Pilzen untersucht. Mit Ausnahme des Acetonextrakts gegen A. niger und des Methanolextrakts gegen M. hiemalis konnte gegenüber allen Pilzen eine antimykotische Wirkung beobachtet werden. Die Inhibierungsrate der Extrakte erreichte 50–52,5 % gegen A. flavus und bis zu 82,5 % gegen M. hiemalis bei der Höchstkonzentration von 5 mg/ml (Lewu et al., 2006).
Einem weiteren Bericht zufolge konnte für Blätter und Wurzeln eine antimykotische Wirkung beobachtet werden, wobei die Blätter eine bessere Wirksamkeit als die Wurzeln zeigten. Man geht davon aus, dass dies mit unterschiedlichen Konzentrationsanteilen der aktiven Komponenten in Wurzeln und Blättern zusammenhängt (Saraswathi et al., 2011).
Antivirale Wirkung
Mithilfe einer Zellkultur wurde das antivirale Verhalten eines wässrigen Wurzelextraktes von P. sidoides überprüft. Konzentrationsabhängig konnte eine antivirale Wirkung gegenüber HSV 1 und HSV 2 festgestellt werden. Eine Inhibierung durch das Extrakt konnte bei beiden Viren nach der Vorbehandlung bzw. auch während der Adsorptionsphase beobachtet werden. Im Gegensatz dazu wirkte Acyclovir lediglich intrazellulär während der HSV-Replikation. Dies zeigt für das Pflanzenextrakt, im Gegensatz zum eingesetzten Acyclovir, einen Einfluss noch vor dem Viruseintritt in die Wirtszelle (Ema/Hmpc, 2011).
Wirksamkeit der Gallussäure gegenüber Rhinoviren
Die humanen Rhinoviren (HRV) stellen eine der bedeutendsten Ursachen für Erkältungen dar. Allerdings konnte noch kein optimales antivirales Mittel gegen die durch Rhinoviren ausgelösten Krankheiten gefunden werden. Mehrere Studien berichten von einer antiviralen Wirkung von Antioxidantien gegenüber verschiedenen Viren. Für die Gallussäure konnte eine solche antioxidative Wirkung festgestellt werden. Aus diesem Grund wurde die Wirksamkeit der Gallussäure gegenüber HRV2 und HRV3 überprüft. Beobachtet wurde in diesem Zusammenhang auch der Effekt der Gallussäure auf den Rhinovirus-induzierten zytopathischen Effekt und die Infektiosität der HRV-Partikel. Das Ergebnis zeigte bei einer Konzentration von 100 mg/ml eine Hemmung der HRV2- und HRV3-Replikation um 55 % ohne zytotoxische Wirkung auf die eingesetzten HeLa-Zellen (human epitheloid-carcinoma-cervic-cells). Bei einer Konzentration von 10 mg/ml konnte für die Gallussäure eine antivirale Wirkung gegen HRV2 von unter 42 % beobachtet werden. Die eingesetzte Vergleichssubstanz Ribavirin zeigte unter 10 mg/ml eine geringere antivirale Wirkung als die Gallussäure. Eine Zugabe der Gallussäure während der Infektion führte zu einer Unterdrückung des Infektionsgeschehens. Hingegen konnte ein Absinken der Infektionsrate auf 35 % und mehr bei der Zugabe nach der Infektion beobachtet werden (Choi et al., 2010).
Immunmodulierende Wirkung
Um die immunmodulierenden Eigenschaften von P. sidoides und deren Inhaltsstoffe zu überprüfen, wurden einige Assays durchgeführt. Wie etwa ein In-vitro-Modell zur intrazellulären Infektion mit Leishmania-donovani-Parasiten, ein extrazelluläres Leishmania-Wachstums-Assay, ein Toxizitäts-Assay für Makrophagen, ein Firoblast-virus protection Assay für die Interferon-Aktivität, ein Fibroblast-lysis Assay für die Tumornekrosefaktor-Aktivität und biochemische Assays für anorganische Stickoxide (iNO = inorganic nitric oxide). Die Wirksamkeit von P. sidoides kann mit der antibakteriellen Aktivität bzw. mit einer Stimulation des nicht spezifischen Immunsystems zusammenhängen.
Murine Makrophagen wurden dann in Folge mit dem intrazellulären Protozoon infiziert. Als Referenzsubstanz wurde Natriumstibogluconat verwendet. Beobachtet wurde dann der mögliche Einfluss auf die Makrophagenaktivierung, sowie die Auswirkungen auf die mögliche Freisetzung von reaktiven Stickstoff-Intermediaten und TNF-Induktion. Das Ergebnis zeigte für keine der getesteten Extrakte und isolierten Inhaltsstoffe (u. a. Methanol-, Ethylacetat-, n-Butanol-Extrakte und etwa Gallussäure, Umckalin etc.) Wirksamkeit gegenüber der extrazellulären, promastigoten Leishmania. Allerdings zeigten alle eingesetzten Extrakte, die Gallussäure und ihre Methylester, Wirkung gegenüber der amastigoten intrazellulären Form von Leishmania donovani. Im Gegensatz dazu zeigten die isolierten Cumarine keine Wirkung bis zu 25 mg/ml.
Dies lässt vermuten, dass die beobachtete Wirkung von P. sidoides gegen die intrazelluläre Leishmania donovani auf einer Sensitivität gewisser Stadien der amastigoten Leishmania gegenüber dem Pflanzenprodukt beruht. Möglich sind auch biochemische Veränderungen des Pelargoniumproduktes im intrazellulären Bereich der parasitophoren Vakuole oder eine Aktivierung der Makrophagen durch die eingesetzten Produkte und dadurch verstärkte Leishmania-Abtötung. Ein Zusammenhang mit der Abtötung intrazellulärer Leishmania und der Freisetzung von iNO konnte nicht nachgewiesen werden.
Die Induktion von TNF-a spielt eine wichtige Rolle im Netzwerk der Zytokine, wie etwa bei der Aktivierung von Immunzellen, und wird zur Abwehr gegenüber bestimmten Pathogenen benötigt. Die Freisetzung von TNF-a ist ein wichtiger Teil der zytokininduzierten Makrophagenaktivierung. Für die Ethylacetat und n-Butanol-Phasen konnte, in einer nicht toxischen Konzentration für die Wirtszelle, eine moderate Aktivierung von TNF-a festgestellt werden. In beiden Phasen konnte eine gewisse Menge an Gallussäure mitsamt seiner Methylester festgestellt werden, welchen das größte Potenzial der TNF-Induktion zugeschrieben wird. Für die Cumarine konnten keine nennenswerten Ergebnisse erzielt werden. In den Proben konnte keine Zytotoxizität gegenüber der Wirtszelle nachgewiesen werden. Allgemein kann gesagt werden, dass vor allem die Gallussäure und ihre Methylester die unspezifische Immunantwort durch Aktivierung der Makrophagen zur intrazellulären Abtötung von Parasiten und die Freisetzungen von iNO und TNF-a verstärken (Kayser et al., 2001).
Weiters wurde ein Versuch mit EPs® 7630 durchgeführt. Das Ergebnis zeigte einen deutlichen Anstieg für die Freisetzung von NO sowie eine Erhöhung der Produktion von IL-1, IL-12 und TNF-a und dadurch eine Reduktion der Überlebensrate von intrazellulären Parasiten. Makrophagen wurden mit Listeria monocytogenes infiziert und mit EPs® 7630 (1–30 mg/ ml) inkubiert und zeigten im Vergleich mit nicht infizierten Makrophagen einen stärkeren Effekt.
In einer weiteren Studie wurde die TNF-a induzierende und eine dem Interferon ähnliche Wirkung von EPs® 7630 festgestellt. Auch konnte eine Stimulierung der IFN-b in den menschlichen MG-63-Zellen (aus dem Osteosakrom) nachgewiesen werden, ebenso eine Erhöhung der Zytotoxizität, ausgelöst durch natürliche Killerzellen. Eine Stimulierung der Genexpression von iNOS und TNF-a erfolgte durch die Stimulierung der RAW-264.7-Zellen durch die Gallussäure aus EPs® 7630 (Ema/Hmpc, 2011).
Modulation von sekretorischen IgA, IL-6 und IL-15
In den letzten Jahren konnte festgestellt werden, dass eine erhöhte sportliche Aktivität die Immunantwort und in Folge das Risiko von Infektionen der oberen Atemwege beeinträchtigen kann. Zusätzlich konnte eine erhöhte Anzahl der Entzündungszellen in den Atemwegen bei Athleten festgestellt werden. In Bezug auf die Konzentrationen von IL-10, IL-1ra, IL-6 und IL-8 wurde bei Athleten mit Infektionen der oberen Atemwege ein deutlichen niedererer Wert gemessen.
In einer Studie von 2011 wurden nun die möglichen immunmodulierenden Effekte von P. sidoides nach einem Hochleistungslauf beobachtet. Im Zuge dessen konnte eine Beeinflussung von P. sidoides auf die Produktion von Serum IL-5 und IL-6 sowie dem intrazellulären IL-15 in der nasalen Mukosa und sekretorisches sIgA nachgewiesen werden. Das sIgA, das eine wichtige Rolle in der Abwehr von Mikroorganismen spielt, wird an der Mukosa freigesetzt.
Verwendet wurde ein ethanolisches Präparat aus P. sidoides und ein Placebo, das dem Pflanzenpräparat in Optik, Geruch und Geschmack ähnelte. Die doppelblinde Studie über 28 aufeinanderfolgende Tagen wurde an 25 Marathonläufern durchgeführt. Die Placebogruppe umfasste 14, die Pelargoniumgruppe 11 ProbandInnen. Am Morgen vor Behandlungsbeginn und 48 Stunden nach dem Lauf wurden Blut-, Speichelproben und Zellen der oberen Atemwege entnommen. Die durchschnittliche Lauflänge und -zeit unterschied sich in beiden Gruppen nicht sonderlich. Es konnte ein deutlicher Anstieg von sekretorischer sIgA in den Gruppen nach erhöhter sportlicher Betätigung beobachtet werden (Luna et al., 2011).
Wirkung gegen Coronaviren
Aufgrund der aktuellen Ereignisse in Bezug auf die Coronapandemie wurde in vitro die Wirksamkeit von EPs 7630 gegenüber SARS-CoV-2 sowie SARS-CoV-2 alpha und beta untersucht. Wie bereits zuvor erwähnt, hat Pelargonium sidoides gute antivirale und immunmodulierende Eigenschaften, weswegen ein Wirkungsnachweis zur Behandlung von SARS-CoV-2 von Interesse war. Auch wegen des Einsatzes der Pflanze bei Erkrankungen der oberen Atemwege war das Ergebnis dieser Studie für die Behandlung von SARS-CoV-2 relevant.
Neben dem Wurzelextrakt EPs 7630 von P. sidoides wurden die Zelllinien VeroFM, VeroE6 und Calu-3 verwendet. Bei den Vero-Zellen handelt es sich um Zellen von Affennierenzellen und bei den Calu Zellen um menschliche Lungenzellen. Beobachtet wurde die Wirkung von 10 bzw. 100 µg/ml Eps 7630 an verschiedenen Zelllinien sowie auch das Verhalten in Abwesenheit des Pelargonium-Extraktes. Zum Einsatz kamen die Coronaviren SARS-CoV-2 und deren Varianten alpha und beta sowie MERS-CoV. Eine Inhibierung des Wachstums aller eingesetzten Coronaviren 48 Stunden nach Inkubierung konnte für 100 µg/ml EPs 7630 mit >99 % festgestellt werden. Bei SARS-CoV-2 konnte eine Hemmung bereits mit 10 µg/ml EPs 7630 gezeigt werden. In den VeroFM-Zellen lag die IC50 von EPs 7630 zur Inhibierung von SARS-CoV-2 bei 0,48 µg/ml und in den Calu-3-Zellen bei 1,61 µg/ml. Beide Konzentrationen lagen deutlich außerhalb des zytotoxischen Bereichs. Ebenso wurde die Wirksamkeit des Wurzelextraktes gegen die Varianten SARS-CoV-2 alpha und beta getestet. Für die Konzentration 100 µg/ml konnte eine Inhibierung dieser Virusvarianten nachgewiesen werden. Bei der Konzentration von 10 µg/ml konnte hingegen keine Reduktion der viralen RNA festgestellt werden.
In weiterer Folge wurde das Eindringen des SARS-CoV-2-Virus auf zellulärer Ebene in Kombination mit einer EPs-7630-Behandlung beobachtet. Das Eindringen in die Zelle erfolgt bei SARS-CoV-2-Viren über die ACE2-Rezeptor-stimulierte Endozytose und über die direkte Bindung (stimuliert von der transmembranären Serinprotease2 (TMPRSS2)) von an ACE2 gebundene SARS-CoV-2-Partikeln mit der Plasmamembran. Zur Simulation beider Wege wurden TMPRSS2-negative Vero-Zellen und TMPRSS2-positive Calu-3-Zellen mit einem SARS-CoV-2-Spikeprotein mit VSVpp (Vesikuläre-Stomatitis-Virus-basierte Pseudopartikel) infiziert. Als Kontrollsubstanzen wurden hier Niclosamid (10 µM) und Camostat Mesilate (100 µM) eingesetzt. Bei Ersterem handelt es sich um einen Hemmer der SARS-CoV-2-Replikation, der möglicherweise auch den endosomalen Eintritt inhibiert. Zweiteres ist ein Serinprotease2-Inhibitor. Am Ende konnte Niclosamid in beiden Zelllinien den Eintritt von SARS-CoV-2 VSVpp um >98 % hemmen. Der Eintritt von VSVpp konnte mit Camostat nur bei TMPRSS2-positiven Calu-3-Zellen gehemmt werden. Das Pelargoniumextrakt EPs 7630 zeigte mit 59 % für die Calu-3-Zellen eine bessere Hemmung in Bezug auf das Eindringen von SARS-CoV-2 VSVpp als für die Vero-Zellen mit lediglich 17 % Hemmung. Daraus kann geschlossen werden, dass durch Eps 7630 der Zelleintritt sowohl über den endosomalen Weg als auch über den durch Plasmamembranfusion vermittelten Weg beeinflusst wird.
Um zu erkennen, welche Fraktionen von EPs 7630 konkret für die Hemmung des Viruseintritts verantwortlich sind, wurde das Pelargonium-Wurzelextrakt mittels Ultrafiltration in Fraktionen aufgeteilt. Die vier Fraktionen reichten, bezogen auf ihr Molekulargewicht, von 1 bis 30 kDA (1–3, 3–5, 5–10 und 10–30 kDa). Im unteren Molekulargewichtsbereich umfassten die Fraktionen Di- bis Hexamere, wohingegen die Fraktionen bis und über 30 kDa Deka- bis Polymere beinhalteten (Umckalin, Umckalinsulfate, kleine Mengen an Purinderivate, polymere Prodelphinidin und polymere Kohlenhydrate). Um nun den Einfluss der Fraktionen zu bewerten, wurden Calu-3-Zellen mit SARS-CoV-2-S VSVpp infiziert und zeitgleich mit je 10 bzw. 100 µg/ml der Fraktionen inkubiert. Für alle Fraktionen konnte bei der Konzentration von 100 µg/ml eine Inhibierung des Viruseintritts beobachtet werden. Ebenso konnte eine Hemmung bei 10 µg/ml für die Fraktionen 10–30, 5–10, 1–3 und <1 kDa festgestellt werden. Die höchste Hemmwirkung wies die Fraktion 1–3 kDa auf. Die Ergebnisse zeigten für die hohen und mittleren Molekulargewicht-Fraktionen (alle außer 1–3 kDa) eine vollständige Hemmung des Viruswachstums bei 100 µg/ml. Niedermolekulare Fraktionen (1–3 und <1 kDa) hingegen erreichten eine Virushemmung von 90 % bei 10 und 66 µg/ml. Daraus lässt sich ein unterschiedliches Wirkverhalten der einzelnen Fraktionen bzw. ein Einfluss des Molekulargewichtes auf die Wirkung feststellen.
Weiters wurden noch die immunmodulierenden Eigenschaften von EPs 7630 und seinen Fraktionen auf Calu-3–Zellen überprüft. Hier zeigte EPs 7630 alleine weder einen erwähnenswerten proinflammatorischen oder entzündungshemmenden noch einen Interferon-abhängigen Einfluss auf die Genexpression. Bei der Infektion von Calu-3-Zellen mit SARS-CoV-2 konnte eine 10- bis 100-fache Erhöhung der Genexpression aller Gene, außer TNFAIP3, 48 Stunden nach der Infektion beobachtet werden. Durch die Behandlung mit dem Pelargoniumextrakt nach der Infektion konnte eine Reduktion der Genexpression (IL1B) und eine Erhöhung des proinflammatorischen TNFAIP3 beobachtet werden. Auch hier zeigten die Fraktionen im unteren Molekulargewichtsbereich (1–3 und <1 kDa) die größte Wirkung auf IL1B und TNFAIP3 während der Infektion. Die übrigen Fraktionen hatten einen geringeren Einfluss auf das entzündungshemmende TNFAIP3-Gen, aber eine höhere Hemmung auf die proinflammatorischen und Interleukin-abhängigen Gene.
Am Ende wurde noch der Einfluss von EPs 7630 auf die Zytokinsekretion beobachtet. Hierbei wurden die Zytokine in An- und Abwesenheit von 100 µg/ml EPs 7630 detektiert. In mit SARS-CoV-2 infizierten Calu-3-Zellen konnte eine erhöhte Produktion von proinflammatorischen Zytokinen, Chemokinen und immunmodulierenden Faktoren festgestellt werden. Bei einer begleitenden Verabreichung von EPs 7630 konnte eine Reduktion einiger Zytokine beobachtet werden. So konnte etwa in den behandelten Celu-3-Zellen eine Senkung des IL-8, IL-13, IL-18 oder TNFa festgestellt werden. Allerdings konnte auch nach der Infektion (8 bzw. 48 h) eine erhöhte Produktion von IL-1b und IL-6 durch EPs 7630 beobachtet werden. Diese Wirkung konnte auch bei nicht infizierten Zellen, die lediglich mit dem Pflanzenextrakt behandelt wurden, beobachtet werden. Dies zeigten die unterschiedlichen immunmodulierenden Eigenschaften von EPs 7630. In Bezug auf die Wachstumsfaktoren und Chemokine konnte in den mit EPs 7630 behandelten Zellen eine Reduktion festgestellt werden. Jene Chemokine und Zytokine, die im direkten Zusammenhang mit COVID-19 stehen (wie etwa: CXCL9, CXCL10 oder VEGF-A), zeigten eine teilweise wirkungsvolle Reduktion (CXCL9 82 %, CXCL10 80 %) durch das Pelargoniumextrakt.
Das Ergebnis der Studie zeigte eine Hemmung des Viruseintritts in die Wirtszelle sowie eine Einschränkung der Virusverbreitung durch EPs 7630. Zusätzlich konnten immunmodulierende Eigenschaften für das Pflanzenextrakt und ein hemmender Einfluss auf die Sekretion vieler Zytokine und Wachstumsfaktoren im Zusammenhang mit einem ernsten COVID-19 Verlauf beobachtet werden. Eine In-vivo-Studie zur Untermauerung der Ergebnisse wäre hier sinnvoll (Papies et al., 2021).
Verhinderung eines Asthmaanfalls durch EPs® 7630
Da die Wirksamkeit von P.-sidoides-Extrakten bei Erkältungen und auch Erkrankungen der oberen Atemwege erfolgreich nachgewiesen wurde, beschäftigte sich eine Studie mit der Möglichkeit der Verhinderung eines Asthmaanfalls bei mit Infektionen der oberen Atemwege erkrankten Kindern durch EPs 7630. Dazu wurden 61 Kinder mit Asthma und Erkältung der oberen Atemwege zwischen 1 und 14 Jahren für diese Studie ausgewählt. Für die Studie zugelassen wurden nur Kinder mit mildem Asthma. Ausschlusskriterien waren u. a. Infektionen der unteren Atemwege und mittelstarkes bis schweres Asthma. Nach der zufälligen Einteilung in zwei Gruppen wurde der Behandlungsgruppe (30 Kinder) ein P. sidoides-Präparat (Umca solüsyon) und als Antpyretikum Paracetamol nach Bedarf und der zweiten Gruppe (31 Kinder) nur die unterstützende Behandlung (Paracetamol) bei Bedarf gegeben. Das Pflanzenextrakt wurde wie folgt dreimal täglich verabreicht: Kinder zwischen 1 und 5 Jahren 10 Tropfen, Kinder zwischen 6 bis 12 Jahren 20 Tropfen und Kindern ab 12 Jahren je 30 Tropfen. Als erstes Ergebnis wertete man den Rückgang der Erkrankungsdauer und Symptomstärke und als zweites dann den möglichen Rückgang der Asthmaanfälle durch EPs 7630. Neben dem allgemeinen Gesundheitszustand wurden zusätzlich noch Blutproben genommen. Das Ergebnis zeigte keinen signifikanten Unterschied in der Zahl der Eosinophilen, im Plasma-IgE-Level und Atopie-Status. Für die mit EPs 7630 behandelte Gruppe konnte eine Reduktion der Symptome (Husten und nasale Symptome) festgestellt werden. Zwischen den Gruppen war in Bezug auf Fieber, Schlaf und Muskelschmerzen kein erwähnenswerter Unterschied zu beobachten. Für den zweiten Messpunkt konnte durch die Behandlung mit EPs 7630 ein deutlicher Rückgang der Asthmaanfälle beobachtet werden (6 Attacken in der Pelargonium-Gruppe und 15 in der No-drug-Gruppe) (Tahan & Yaman, 2013).
EPs® 7630 zur Vermeidung bzw. Reduktion der Antibiotikaverwendung bei Infektionen der oberen und unteren Atemwege
Im Jahr 2020 beschäftigte sich eine Studie (Martin et al., 2020) mit der Reduktion einer Antibiotika-Notwendigkeit nach der primären Einnahme eines Phythopräparates bei Infektionen der oberen und unteren Atemwege. Häufig kommt es bei genannten Erkrankungen zu einer raschen Verschreibung von Antibiotika. Dies kann allerdings neben unerwünschten Nebenwirkungen auch zu Unwirksamkeit bis hin zu einer möglichen Antibiotikaresistenz führen. Verschiedene Phytopräparate zeigten bereits gute Wirksamkeit gegen Atemwegsinfektionen. So auch Wurzelextrakte von Pelargonium sidoides, die hier in Form von EP® 7630 zum Einsatz kamen.
Die Studie erfolgte an 117.182 PatientInnen, die in einem Zeitraum von Jänner 2015 bis März 2019 ausgewählt wurden. Einbezogen wurden PatientInnen von AllgemeinmedizinerInnen (67 %), HNO-ÄrztInnen (5,5 %) und PädiaterInnen (28 %), die mit zumindest einer akuten Infektion der oberen und unteren Atemwege in diesem Zeitraum diagnostiziert wurden. Der erste dokumentierte Zeitpunkt der Erkrankung in diesem Zeitrahmen wurde als Indexdatum definiert. Es wurden nur PatientInnen in die Studie aufgenommen, welche bereits mindestens 12 Monate vor dem Indexdatum unter Beobachtung standen. Ausgeschlossen wurden PatientInnen, die Antibiotika (ATC Code: J01; das sind Antibiotika zur systemischen Behandlung wie etwa Tetracycline, Sulfonamide, Beta-Lactam-Antibiotika etc. (Diagnosia Premium, 2022)) zum Indexdatum oder 90 Tage zuvor einnahmen, sowie PatientInnen mit einer bakteriellen Infektion 90 Tage vor dem Indexdatum. Als Studienendpunkte wurde zumindest eine Verschreibung mit einem Antibiotikum (ATC-Code: J01) während eines Krankheitsverlaufs sowie die Dauer des Krankenstandes definiert. Neben EP® 7630 wurden noch weitere gängige Phytopharmaka (ATC R01 bis R05) getestet, u. a. mit Thymian-Extrakt, Holunderblüten oder auch Eukalyptusöl. All jene PatientInnen, denen ein Phytopräparat am Indexdatum verschrieben wurde, wurden 1:1 gematcht. Dafür wurde zufällig eine Person ohne Medikation ausgewählt, die aber in Bezug auf Alter, Geschlecht, Versicherungsstatus, Indexjahr, Behandlungsform, Diagnose sowie den Charloson-Komorbiditäts-Index (CCI) mit der behandelten Person zusammenpasste. Untersucht wurde nun der Zusammenhang zwischen dem Einsatz von Phytopharmaka und einer anschließenden Antibiotikabehandlung. Dafür wurden die einzelnen PatientInnen anhand ihres jeweiligen Matches beurteilt. Zur Beurteilung der Dauer des Krankenstandes der jeweiligen PatientInnen wurden lediglich PatientInnen im Alter zwischen 20 bis 60 Jahren ausgewählt. RentnerInnen wurden hier nicht gewertet.
Als durchschnittliche Dauer des Krankenstandes wurden drei Tage festgestellt. Um den Zusammenhang zwischen der Verwendung von Phytopharmaka und die Krankheitsdauer festzustellen, wurde ein logistisches Regressionsmodell mit den Krankheitstagen (länger als 3, 7, 10, 14, 18, 21 oder 28 Tage) als binäre Variablen verwendet. Ein p-Wert von <0,05 wurde als signifikant angenommen.
Unter den PatientInnen war die einzige überwiegend einheitliche Diagnose eine Erkrankung bzw. akute Infektion der oberen Atemwege (neben u. a. Sinusitis, Husten, Pharyngitis usw.).
In Bezug auf das Pelargoniumpräparat wurde dies bei AllgemeinmedizinerInnen in 2.326 Fällen und bei KinderärztInnen in 574 Fällen verschrieben. Zusammen mit dem in anderen Fällen verschriebenen Thymianextrakt (OR (odds ratio) 0,62) zeigte Pelargonium sidoides (OR 0,49) bei den von den AllgemeinmedizinerInnen betreuten PatientInnen den größten Erfolg.
Bei den Kindern zeigten neben dem Pelargoniumpräparat (OR 0,57) auch Extrakte von Thymian und Efeu (OR 0,66) und Thymian und Primelwurzel (OR 0,67) gute Ergebnisse. In Bezug auf die Krankenstandsdauer zeigte neben Cineol (OR 0,74; p = 0,029), das Pelargonium-Wurzelextrakt (OR 0,79; p = 0,025) die besten Ergebnisse.
Es wurden nur wenige zusätzliche bakterielle Infektionen der unteren und oberen Atemwege dokumentiert (225 Fälle bei den AllgemeinmedizinerInnen und 782 Fälle bei den KinderärztInnen).
Allgemein konnte eine Reduktion der Antibiotikanotwendigkeit durch die zu Beginn der Krankheit eingesetzten Phytopharmaka beobachtet werden, ebenso wie eine Verkürzung der Krankheitsdauer. Der Grund für die verringerte Notwendigkeit von Antibiotika wird in den geringeren bakteriellen Folgen nach den Atemwegsinfektionen vermutet. Diese Vermutung konnte allerdings in dieser Studie nicht bestätigt werden. Zusätzlich wurden noch die aktiven Inhaltsstoffe der jeweiligen Pflanzen als positive Komponente gewertet. So bringen viele der Pflanzen etwa antivirale, antibakterielle, mykolytische, sekretolytische, entzündungshemmende und immunstimulierende Eigenschaften mit sich, die etwa eine Senkung der Hustenfrequenz nach sich ziehen oder auch mykolytische und bronchorelaxierende Wirkungen haben und so das Heilungsgeschehen beeinflussen und fördern. Grund für die Verschreibung von Antibiotika ist außerdem häufig die Dauer einer Atemwegserkrankung und weil in der Praxis für Ärztinnen und Ärzte oft keine genaue Unterscheidung zwischen einer bakteriellen und einer viralen Infektionen möglich ist und sie durch die Verschreibung mögliche bakterielle Komplikationen verhindern wollen. Ein möglicher Grund für die geringere Verschreibung von Antibiotika in der Phytopharmaka-Gruppe könnten auch die oben genannten positiven Eigenschaften der Pflanzenpräparate sein. So konnte etwa bei den PatientInnen, die mit Pelargonium behandelt wurden, eine raschere Verbesserung der Erkältungssymptome beobachtet werden. In einer Metastudie (Matthys et al., 2010) wurde dies bestätigt. Hier konnten Erwachsene durchschnittlich am siebenten Tag nach Erkrankungsbeginn die Arbeit bereits wieder aufsuchen. Auch Kinder und ältere Personen hatten eine größere Wahrscheinlichkeit, nach sieben Tage Besserung zu erlangen und etwa wieder den Kindergarten zu besuchen.
Allgemein kann gesagt werden, dass der Einsatz von Phytopharmaka bei Infektionen der oberen und unteren Atemwege zu einer signifikanten Reduktion der Antibiotikanotwendigkeit sowie der Dauer des Krankenstandes führt (Martin et al., 2020).
Wirksamkeit und Verträglichkeit von EPs®-7630-Tabletten bei akuter Bronchitis
Die Wirksamkeit und Verträglichkeit von EPs-7630-Tabletten wurde an Erwachsenen mit akuter Bronchitis in einer randomisierten, doppelblinden, placebokontrollierten Studie getestet. Für EPs 7630 konnten bereits gute Erfolge bei der Behandlung von chronischer Bronchitis und Rhinosinusitis beobachtet werden. Die Studie (Matthys et al., 2010) erfolgte 2006 in der Ukraine parallel an vier Gruppen. Die ProbandInnen wurden zu Beginn getestet und für die Studie ausgewählt und anschließend für sieben Tage behandelt (doppelblind). Dazwischen wurden sie dreimal kontrolliert (Tag 0, zwischen Tag 3 und 5 und Tag 7). Die vier Studiengruppen wurden mit EPs-7630-Filmtabletten in den Stärken 10, 20 oder 30 mg (Pelargonium-sidoides-Wurzelextrakt mit 11%igem Ethanol (w/w) als Extraktionsmittel) und einem Placebo behandelt. Alle Gruppen wurden angehalten, ihre Tablette dreimal täglich eine halbe Stunde vor der Mahlzeit einzunehmen (30 mg, 60 mg und 90 mg).
Getestet wurde an Männern und Frauen über 18 Jahren (405 Personen), die maximal 48 Stunden an akuter Bronchitis litten und einen BSS-Wert (bronchitis-specific symptoms) von mindestens 5 Punkten aufwiesen. Am Ende waren es je 102, 102, 101 und 100 PatientInnen in der Placebo-, 30-mg-, 60-mg- und 90-mg-Gruppe. Von der Studie ausgeschlossen wurden PatientInnen, die innerhalb eines Monats vor Studienbeginn bereits an einer anderen Studie teilgenommen haben, sich in Antibiotika-, ACE-Hemmer-, b-Blocker-, Bronchodilatator- oder Glucocorticoid-Therapie befanden. Außerdem durften ProbandInnen, die gerade mit Analgetika, Sekretolytika, Mukolytika oder Antitussiva behandelt wurden, nicht teilnehmen. Weitere wichtige Ausschlusskriterien waren eine mögliche Pneumonie, allergisches Asthma oder eine bakterielle Erkrankung der oberen Atemwege sowie Herz-, Nieren-, Lebererkrankungen oder eine Immunsuppression. Den PatientInnen war es erlaubt, bei Fieberschüben (>39 °C) maximal dreimal täglich zusätzlich Paracetamol (500 mg) einzunehmen.
Die Wirksamkeit des Pflanzenpräparates wurde zuerst anhand der Änderung typischer Bronchitis-Symptome gemessen (1. Messpunkt). Gemessen wurden die BSS von Tag 0 bis 7. Die BSS umfassten folgende Symptome, die typisch für eine akute Bronchitis sind: Husten, Sputum, Lungenrasen beim Abhören, Brustschmerzen während des Hustens und Atemnot. Diese wurden auf einer Skala von 0 (Symptom nicht vorhanden) bis 5 (Symptom sehr stark) bewertet.
Als zweite Wirksamkeits-Variable (2. Messpunkt) wurden folgende Reaktionen auf die Behandlung gemessen: Der gesamte BSS-Wert mit unter drei Punkten an Tag sieben, eine Senkung des gesamten BSS-Wertes um mindestens sieben Punkte zwischen Tag 0 und Tag 7 und eine Kombination aus der Änderung der BSS und der zweiten Wirksamkeits-Variablen. Die Behandlungsergebnisse wurden am Ende mithilfe der Integrative Medicine Outcome Scale (IMOS) mit den Werten 1 (vollständige Genesung) bis 5 (Verschlechterung) gemessen. Des Weiteren wurden u. a. der Beginn des Behandlungseffektes, die zusätzliche Einnahme von Paracetamol, die individuellen BSS-Symptome und allgemeinen Veränderungen von Symptomen (Kopfschmerzen, Heiserkeit, Gliederschmerzen, Ermüdung/Erschöpfung) sowie die Dauer der Arbeitsunfähigkeit beobachtet und dokumentiert. Zusätzlich sollten die PatientInnen die Zufriedenheit ihrer Behandlung auf einer Skala von 1 (sehr zufriedenstellend) bis 5 (nicht zufriedenstellend) bewerten.
Die Verträglichkeit wurde bewertet, indem die Nebenwirkungen sowie die Laborsicherheitsparameter (g-Glutamyltranspeptidase, Aspartat-Aminotransferase, Alanin-Aminotransferase, Erythrozyten-Sedimentationsrate), Leukozyten, Quick-Werte, Thromboplastin-Zeit sowie Blutdruck, Puls und Körpertemperatur) gemessen und dokumentiert wurden.
Die Ergebnisse in Bezug auf die Wirksamkeit zeigten für die Tage zwischen 0 und 7 eine Senkung der BSS-Werte für die Placebogruppe um 2,7 ± 2,3 Punkte, für die 30-mg-EP-7630-Gruppe um 4,3 ± 1,9 Punkte, für die 60-mg-Gruppe um 6,1 ± 2,1 Punkte und für die 90 mg Gruppe um 6,3 ± 2,0 Punkte. Vor allem an Tag 3 bis 5 konnte für die Behandlungsgruppen im Vergleich zur Placebogruppe eine deutliche Verbesserung der Gesamt-BSS-Werte beobachtet werden. Diese hielt bis zum siebenten Tag dosisabhängig an.
In Bezug auf den 2. Messpunkt war die Rücklaufquote in der Behandlungsgruppe höher als in der Placebogruppe. Das erste Messkriterium (gesamter BSS-Wert <3 Punkte an Tag 7) wurde von der Placebogruppe nur zu 5,9 % und in den Behandlungsgruppen zu 24,5 % (30 mg), 57,4 % (60 mg) und 55,0 % (90 mg) erfüllt. Das zweite Messkriterium (Senkung der gesamten BSS-Werte um mindestens sieben Punkte von Tag 0 bis 7) wurde in der Placebogruppe zu 6,9 % und in den Behandlungsgruppen zu je 14,7 % (30 mg), 43,6 % (60 mg) und 46,0 % (90 mg) erfüllt. Für das dritte Messkriterium (eine Kombination aus den beiden vorangegangenen Messungen) schnitt ebenso die Placebogruppe (2,9 %) schlechter ab als die Behandlungsgruppen (6,9 % (30 mg), 33,7 % (60 mg), 31,0 % (90 mg)). Allgemein war die größte Reduktion an BSS-Symptomen von Tag 0 bis 7 in den Behandlungsgruppen sichtbar.
Die zusätzliche Verwendung von Paracetamol war allgemein nicht sehr hoch. Am wenigsten verwendet wurde es in den Gruppen mit 60 und 90 mg EPs 7630 zwischen den Tagen 3 bis 7. Im Gegensatz zu den Behandlungsgruppen berichteten die ProbandInnen der Placebogruppe, dass sie keinen Effekt der Behandlung bemerkten (42,2 %) bzw. einen Wirkungseintritt nicht vor Tag 5 bis 7 (38,4 %) beobachten konnten. Im Gegensatz dazu bemerkten 59,4 % der 60-mg-Gruppe und 67,9 % der 90-mg-Gruppe eine Verbesserung zwischen Tag 1 und 4. Für die Arbeitsunfähigkeit konnte in allen Gruppen eine Reduktion beobachtet werden, wobei die Behandlungsgruppen auch hier wieder besser als die Placebogruppe abschnitten. Durchschnittlich lag die Arbeitsunfähigkeit für die Placebogruppe bei 8 Tagen und für die Behandlungsgruppen bei 6 Tagen. In Bezug auf die Körpertemperatur und den Puls konnte in den Behandlungsgruppen eine Reduktion festgestellt werden. Bei den oben genannten Laborparametern konnten keine signifikanten Änderungen festgestellt werden. Bei 18,5 % der PatientInnen konnten insgesamt 92 milde bzw. moderate Nebenwirkungen dokumentiert werden. Am häufigsten traten hier gastrointestinale Beschwerden auf. Alle Gruppen waren davon betroffen (Placebo 6 von 102, 30-mg-Gruppe 5 von 102 PatientInnen, 60-mg-Gruppe 9 von 101 und in der 90-mg-Gruppe 15 von 101) und die Anzahl nahm auch mit zunehmender Dosierung zu.
Am Ende kann gesagt werden, dass eine positive Wirkung zur Behandlung einer akuten Bronchitis für alle Behandlungsgruppen festgestellt werden konnte. Die Behandlungsdauer von sieben Tagen war gleich wie in anderen bereits durchgeführten Studien. Eine Verbesserung der Wirksamkeit von EPs 7630 konnte mit steigender Dosis festgestellt werden. Allerdings konnte für eine Dosis über 60 mg kein zusätzlicher oder besserer Effekt beobachtet werden. Damit konnte als optimale Dosierung, mit dem besten Wirkungs- und Sicherheits-Verhältnis, 60 mg EPs 7630 täglich ausgemacht werden. Die gute Verträglichkeit ließ sich dadurch nachweisen, dass alle ProbandInnen die Behandlung gut einhielten und sich gut an die Einnahmevorschriften hielten.
Allgemein konnte die Wirksamkeit gegenüber einer akuten Bronchitis und auch eine Verkürzung der Arbeitsunfähigkeit durch eine Behandlung mit EPs 7630 nachgewiesen werden (Matthys et al., 2010).
Wirksamkeit von EPs 7630 bei PatientInnen mit Erkältung
In einer randomisierten, doppelblinden, placebokontrollierten klinischen Studie (Phase 3) wurde die Wirksamkeit eines Pelargoniumextraktes (EPs 7630) bei Erkältung geprüft. Die 103 männlichen und weiblichen ProbandInnen wurden nach folgenden Kriterien ausgewählt: Anwesenheit von zwei schweren und zumindest einem leichten Erkältungssymptom oder einem schweren und mindestens drei leichten Erkältungssymptomen. Als schwere Erkältungssymptome wurden Halsentzündung und eine rinnende Nase, als leichte Symptome verstopfte Nase, Niesen, Heiserkeit, kratzender Hals, Husten, Kopf-, Muskelschmerzen und Fieber definiert. Die Dauer der Symptome sollte maximal 48 Stunden zurückliegen. Hauptausschlusskriterien waren u. a. eine Antibiotikabehandlung, schwere Herz-, Nieren- und Lebererkrankungen sowie Diabetes mellitus, Sinusitis, Mandelentzündung und Mittelohrentzündung.
Als primäres Ergebniskriterium wurde die Summe der Differenzen der Symptomintensitäten (SSID, sum of symptom intensity difference) der Erkältungsintensität-Werte (CIS, cold intensity score) von Tag eins bis fünf festgelegt. Der CIS-Wert besteht aus 10 Symptomen, die mit einer Erkältung einhergehen, in schwere und leichte Symptome eingeteilt werden und bereits oben erwähnt wurden. Die Symptome und auch Fieber sollten mit einem Punktesystem bewertet werden, mit einem Maximalwert für CIS von 40 Punkten. Die zu vergebenen Punkte 0 bis 4 wurden interpretiert als 0 für symptomfrei und 4 für starke Symptomlast. Das zweite Ergebniskriterium war u. a. die Verbesserung bzw. Veränderung der CIS-Werte, Verbesserung weiterer Erkältungssymptome, Arbeitsfähigkeit, allgemeines Wohlbefinden und Aktivitätslevel der einzelnen ProbandInnen. Als genesen wurde ein CIS-Wert von 0 bzw. <1 und damit das Fehlen jeder Art von Symptomen bzw. die Anwesenheit maximal eines Erkältungssymptomes bewertet. Auch hier wurden die ProbandInnen dazu aufgefordert, ein Tagebuch über ihren täglichen Gesundheitszustand zu führen. Kontrolltermine fanden an Tag drei, fünf und zehn statt. Verabreicht wurde den TeilnehmerInnen der Studie ein Wurzelextrakt aus P. sidoides (EPs 7630) (52 ProbandInnen) und ein Placebopräparat (51 ProbandInnen). Unabhängig von der Gruppe sollten sie mindestens 30 Minuten vor einer Mahlzeit dreimal täglich 30 Tropfen zu sich nehmen. Die Behandlungsdauer betrug 10 Tage.
Zu Beginn wurde der CIS-Wert beider Gruppen ermittelt. Dieser ergab für die Behandlungsgruppe 17,8 ± 4,0 Punkte und für die Placebogruppe 16,9 ± 3,4 Punkte. Nach dem fünften Behandlungstag sank der CIS-Wert um 10,4 ± 3,0 (Behandlungsgruppe) bzw. 5,6 ± 4,3 (Placebogruppe) Punkte. Mithilfe der ermittelten CIS-Werte von Tag eins, drei und fünf konnte am Ende die SSID berechnet werden. Vom Beginn bis zum Tag fünf verbesserte sich der SSID-Wert in der Behandlungsgruppe um 16,6 ± 5,3 und in der Placebogruppe um 7,6 ± 7,5 Punkte. Hier konnte bereits ein eindeutiges Ergebnis zugunsten von EPs 7630 beobachtet werden.
In weiterer Folge konnte eine signifikante Verringerung aller schweren und leichten Symptome (CIS-Wert) nicht nur von Tag eins bis fünf, sondern auch bis Tag zehn, vor allem bei der Behandlungsgruppe, beobachtet werden. So zeigte sich auch hier ein deutlicher Vorteil der Behandlungsgruppe gegenüber der Placebogruppe. So konnten am fünften Tag für die Behandlungsgruppe bereits zwei Responder-Kriterien erfüllt werden, nämlich eine Verringerung der CIS-Werte unter sieben Punkte (bei 42,3 %; Vergleich Placebogruppe: 3,9 %) sowie eine CIS-Reduktion um ³7 Punkte (bei 94,2 %, Vergleich Placebogruppe: 43,1 %). Am 10. Behandlungstag konnte eine vollständige Genesung in der Behandlungsgruppe mit 0 CIS-Punkten bei 63,7 % und mit <1 Punkt bei 78,8 % festgestellt werden. Somit zeigte sich im Vergleich mit der Placebogruppe (0 Punkte: 11,8 %; <1 Punkte: 31,4 %) wieder ein eindeutiges Ergebnis zugunsten der Behandlungsgruppe. Auch bei der Verbesserung weiterer erkältungstypischer Symptome, wie etwa Gliederschmerzen, Schwäche und Erschöpfung, schnitt die Behandlungsgruppe besser ab, auch in Bezug auf die rhinologischen Beschwerden. So zeigte am letzten Behandlungstag lediglich einer der 52 PatientInnen der Behandlungsgruppe – im Vergleich zu fünf bis zwölf der 51 PlaceboprobandInnen der Placebogruppe – rhinologische Beschwerden. Auch die Länge der Arbeitsunfähigkeit lag in der Behandlungsgruppe mit 9,9 ± 1,8 Tagen unter jener der Placebogruppe mit 8,2 ± 1,9 Tagen.
Allgemein zeigte die EPs-7630-Gruppe eine schnellere Genesung und Symptomlinderung im Vergleich zur Placebogruppe. Dies ging auch aus den Tagebuchaufzeichnungen hervor, in denen die PatientInnen der Behandlungsgruppe früher als jene der Placebogruppe etwa über verbesserten Schlaf oder Wachsamkeit berichteten. Zu nennenswerten Nebenwirkungen kam es nicht und auch in puncto Verträglichkeit wurden keine negativen Effekte beobachtet.
Die Studie konnte für das Pflanzenextrakt eine gute Wirksamkeit und Sicherheit bei der Behandlung einer Erkältung bei Erwachsenen, im Unterschied zum eingesetzten Placebopräparat, nachweisen. Erkältungsdauer und Symptome ließen sich durch die Einnahme vom Pelargoniumextrakt deutlich reduzieren und eine raschere Genesung trat ein. Im Vergleich konnten etwa nur bei weniger als 5 % der mit Placebo Behandelten eine Verbesserung der Erkältung am 5. Tag der Behandlung beobachtet werden. Zur selben Zeit hatten bereits etwa zwei Drittel der ProbandInnen der Behandlungsgruppe eine vollständige Genesung bzw. eine deutliche Verbesserung des Gesundheitszustandes erreicht. Allgemein konnte somit für den Einsatz des Pelargonium-sidoides-Extraktes bei Erkältungen gute eine gute Wirkung erzielt werden. Nachweislich wurde die Erkältung verkürzt und die Symptome konnten rascher reduziert werden (Lizogub et al., 2007).
Metaanalyse zur Wirksamkeit von EPs 7630 bei Kindern mit einer akuten Infektion der Atemwege
Für die 2019 verfasste Metastudie wurden sechs Studien (2003 bis 2016) zusammengefasst. Diese beschäftigten sich mit der Wirksamkeit von EPs 7630 bei Kindern, die an akuter Mandelentzündung oder akuter Bronchitis erkrankt waren. Bei den Studien handelte es sich um doppelblinde, randomisierte, placebokontrollierte Verfahren. Drei der sechs Studien (A, B, C) beschäftigten sich konkret mit der Behandlung der akuten Mandelentzündung mit EPs 7630 bei Mädchen und Buben zwischen sechs und zehn Jahren, die Symptome einer Mandelentzündung für maximal 48 Stunden aufwiesen. Ein negativer Antigentest war für die Kinder zur Studienteilnahme notwendig, um eine durch Streptokokken A ausgelöste Mandelentzündung auszuschließen. Ebenso mussten typische Symptome einer Mandelentzündung wie etwa u. a. roter Hals, Schluckbeschwerden, Fieber vorhanden sein. Behandelt wurden die Kinder für sechs Tage.
Die übrigen drei Studien (D, E, F) testeten die Wirksamkeit von EPs 7630 bei einer akuten Bronchitis. Auch hier wurden Mädchen und Buben zwischen sechs und zehn Jahren getestet und ebenso wie bei den anderen Studien musste eine gewisse Anzahl von typischen Symptomen vorhanden sein und der Beginn der Erkrankung durfte maximal 48 Stunden zurückliegen. Die StudienteilnehmerInnen der Studien D und F erhielten EPs 7630 in Form einer Lösung, wohingegen es sich bei Studie E um eine dosisfindende Studie handelte. Die PatientInnen wurden hier in Gruppen unterteilt und erhielten EPs 7630 in Form von Tabletten, jeweils 3 x 10, 3 x 20 oder 3 x 30 mg/Tag. Zusätzlich gab es noch eine Placebogruppe. In diese Metastudie wurden nur Kinder mit 3 x 20 mg und Placebobehandlung berücksichtigt. Die TeilnehmerInnenzahl aller Studien betrug am Ende für die Behandlungsgruppen 265 und für die Placebogruppen 258.
Als Zusatzbehandlung und bei Fieber ³38,5 °C war in allen Studien Paracetamol in Form von Zäpfchen oder Tabletten erlaubt. So durfte in den Studien zur akuten Mandelentzündung, an den Tagen 0 bis 4 nach Behandlungsbeginn, pro Tag maximal 3 x 500 mg Paracetamol verabreicht werden. Studien D und F erlaubten für unter Sechsjährige 3 x 250 mg Paracetamolzäpfchen pro Tag, während in Studie D ältere Kinder bis zu 3 x 500 mg Tabletten einnehmen durften. Studie F erlaubte 3 x 500 mg Zäpfchen für Kinder zwischen sieben und zehn Jahren und 3 x 500 mg Tabletten für die älteren Kinder. In der Studie E waren hingegen 3 x 500 mg Tabletten pro Tag für alle StudienteilnehmerInnen aller Altersgruppen erlaubt. Für alle Studien galt das Gebot, die eingenommene Zusatzmedikation genau zu dokumentieren.
Die Wirksamkeit von EPs 7630 zur Symptombehandlung bei einer akuten Mandelentzündung wurde in den Studien A–C überprüft. So wurde in der Studie A als erster Messpunkt die Reduktion des Gesamt-TSS-Werts (£ 4Punkte) am vierten Behandlungstag gemessen. Die Behandlungsgruppe zeigte hier eine Verbesserung von 90 % der 40 Kinder im Vergleich zu 44,7 % der 38 Kinder, die Placebo erhielten. Bei den Studien B und C wurde als erster Messpunkt die Änderung des TSS-Werts zwischen Tag 0 und 4 festgelegt. Für die Studie B konnte eine Reduktion des TSS-Werts von 6,7 ± 2,7 Punkte in der Behandlungsgruppe und von 3,3 ± 4,2 in der Placebogruppe festgestellt werden. In Studie C war die Reduktion des TSS-Werts in der EPs-7630-Gruppe 7,1 ± 2,1 Punkte und in der Placebogruppe 2,5 ± 3,6 Punkte.
Die Wirksamkeitsprüfung von EPs 7630 gegen akute Bronchitis wurde in den Studien D–F getestet. Hier wurde die Änderung des BSS-Gesamtwerts zwischen dem Behandlungsbeginn und Tag sieben gemessen. In der Studie D konnte eine Reduktion des BSS-Werts um 3,4 ± 1,8 Punkte in der Behandlungsgruppe und um 1,2 ± 1,8 Punkte in der Placebogruppe festgestellt werden. Durch die Behandlung mit 3 x 20 mg/Tag in der Studie E konnte eine Reduktion um 4,4 ± 2,4 Punkte und für die Placebogruppe um 3,3 ± 2,6 Punkte beobachtet werden. In Gruppe F zeigte die EPs-7630-Gruppe eine Reduktion um 4,4 ± 1,6 Punkte und die Placebogruppe eine Reduktion um 2,9 ± 1,4 Punkte. Zusätzlich muss hier erwähnt werden, dass die ProbandInnen der Studien zur akuten Bronchitisbehandlung (Studien D bis F) zwischen 0 und 18 Jahre alt waren. Die speziell in dieser Metastudie betrachtete Altersgruppe von 6 bis 10 Jahren wurde nicht extra aus diesen Studien ausgeschlossen.
Es konnte in den Studien der akuten Bronchitisbehandlung eine geringere Paracetamoleinnahme als bei der Behandlung einer akuten Mandelentzündung beobachtet werden. Allgemein konnte für die Behandlungsgruppen eine geringere Paracetamolverwendung im Vergleich zur Placebogruppe beobachtet werden. Die Zahl der Kinder, die am Ende der Behandlung nicht die Schule besuchen konnten, wurde in den zusammengefassten Daten aller Studien festgehalten. Dies traf auf 80 der 265 Kinder aus der Behandlungsgruppe und 192 der 258 Kinder der Placebogruppe zu.
Allgemein konnte eine Wirksamkeit von EPs 7630 bei der Behandlung von akuter Bronchitis und akuter Mandelentzündung festgestellt werden. Da die Messung des Fiebers von den Eltern in den Studien nicht dokumentiert werden musste, musste man sich hier darauf verlassen, dass das Paracetamol zusätzlich wirklich nur bei Fieber ab 38,5 °C gegeben wurde. Die geringere Notwendigkeit einer Paracetamol-Zusatzbehandlung bei den Kindern der Behandlungsgruppen spricht für die Wirksamkeit des Pelargonium-sidoides-Extrakts. So führt man den besseren Krankheitsverlauf auf die Wirksamkeit der Pflanze zurück. Bessere Ergebnisse in Bezug auf die Wirksamkeit von EPs 7630 konnten in der Behandlung von akuter Bronchitis nachgewiesen werden (Seifert et al., 2019).
EPs 7630 vs. Amoxicillin in der Behandlung einer leichten bakteriellen Rhinosinusitis
In der Zeit zwischen März 2018 und Mai 2019 wurde an einer kleinen ProbandInnengruppe die Wirksamkeit von EPs 7630 im Vergleich zum Antibiotikum Amoxicillin bei einer leichten bakteriellen Rhinosinusitis geprüft. Die offene Studie umfasste 50 ProbandInnen mit diagnostizierten leichten bis mittelschweren Symptomen einer akuten bakteriellen Rhinosinusitis (ABRS). Den ProbandInnen wurde zusätzlich aus der Nase eine Probe genommen und diese wurde auf Blutagarplatten kultiviert. Ausschlusskriterien für die Teilnahme waren u. a. Operationen im Nasenbereich innerhalb der letzten sechs Monate, allergische Rhinitis, Bronchialasthma, Einnahme von Aspirin, Antihistaminika, Corticosteroide, Schwangerschaft und Stillzeit sowie ein Alter der ProbandInnen unter 18 und über 65 Jahre.
Die 50 ProbandInnen wurden in zwei Gruppen zu je 25 Personen unterteilt. Eine Gruppe erhielt dreimal täglich EPs 7630 in Form von 20-mg-Tabletten. Die zweite Gruppe erhielt dreimal täglich 500-mg-Tabletten Amoxicillin. Beide Gruppen mussten ihre jeweilige Behandlung 10 Tage lang beibehalten. Es wurden in keiner der beiden Gruppen weitere pflanzliche Mittel oder Antibiotika eingenommen. Die Stärke der Symptome wurde anhand einer Skala von 0 (keine bis milde Symptome) bis 10 (starke Symptome) eingeteilt und am Beginn sowie am Ende der Behandlung dokumentiert. Als Messpunkte wurden am Ende die Gesamtsymptome (TSS = total symptoms score), die individuellen Werte der einzelnen Symptome sowie die endoskopischen Befunde (gesamte und individuelle Befunde) vor und nach der Behandlung ausgewertet.
Das Ergebnis zeigte zunächst eine Reduktion der Symptome in beiden Gruppen. In Bezug auf die Gesamtsymptome konnte für die EPs-7630-Gruppe eine bessere Wirkung im Vergleich mit Amoxicillin ab dem 7. Behandlungstag beobachtet werden. Davor war die Reduktion der Gesamtsymptome sehr ähnlich. Dies lässt darauf schließen, dass die Wirkung von EPs 7630 langsam zunimmt, bevor sie schließlich ihre volle Wirksamkeit entfalten kann. Beim Betrachten der einzelnen Symptome (Gesichtsschmerzen, verstopfte Nase, gestörter Geruchssinn, Schleimhautödem, eitrig-schleimige Sekretion) konnte auch hier für die EPs-7630-Gruppe eine bessere Wirkung dokumentiert werden. In Bezug auf Rhinorrhoe und retronasalen Schleimfluss konnte kein Unterschied in den beiden Behandlungsgruppen festgestellt werden. Grund dafür könnte der mäßige Einfluss von Pelargonium sidoides auf die Sekretion sein. Weiters konnte in der Pelargonium-Gruppe durch die Behandlung deutliche Reduktionen von Streptococcus pneumoniae, Haemophilus influenzae und Moraxella catarrhalis beobachtet werden. In der mit Amoxicillin behandelten Gruppe wurden nur Reduktionen von Streptococcus pneumonie und Haemophilus influenzae vermerkt.
Abschließend kann gesagt werden, dass die Studie bessere Ergebnisse in Bezug auf die Gesamtsymptome und das Bakterienwachstum bezüglich der Verwendung von EPs 7630 im Vergleich zu Amoxicillin bei der Behandlung einer Rhinosinusitis zeigte. Allerdings muss auch gesagt werden, dass die ProbandInnenzahl äußerst gering war, was als Nachteil der Studie gewertet werden kann. Weitere Untersuchungen und Studien an einer größeren Zahl an ProbandInnen wären notwendig (Perić et al., 2020).


