Oberirdische Teile
SOJA (Glycine max.)
Soja ist eine vielseitige Pflanze und ein weit verbreitetes Lebensmittel. Die Bohne ist eine Quelle von Proteinen, Kohlenhydraten und Fetten und ist ein bedeutendes Lebensmittel für Millionen von Menschen auf der ganzen Welt. Soja ist auch reich an Isoflavonen, die viele gesundheitliche Vorteile haben.
Verschiedene Soja–Produkte stehen als Lebensmittel, Nahrungsergänzungsmittel und Arzneimittel, inklusive ganzer Sojabohnen, Tofu (Bohnenquark), fermentiertes Soja (Tempeh), Sojaprotein–Pulver, Sojasprossen, Soja–Extrakte und Soja–Isoflavone (wie z.B. Genistein) zur Verfügung.
Die Sojabohne stammt aus Ostasien und ist eine bedeutende Quelle von Protein und Öl für geschätzte 1.5 Milliarden Menschen auf der ganzen Welt. Die typischen, von Soja abgeleiteten Lebensmittel sind gekochte Bohnen, Sojasprossen, Sojamilch und Tofu (Bohnenquark). Soja enthält Isoflavone, die medizinische Eigenschaften haben.
Traditionelle fermentierte Sojaprodukte umfassen Sojasoße, fermentierte Bohnenpaste, die als Miso, Natto und Tempeh bezeichnet werden. Miso und Natto sind aglykon–reiche fermentierte Sojaprodukte, während Tofu ein glucosidreiches unfermentiertes Sojaprodukt ist. Die aktuellen Studien zeigten, dass die Einnahme von aglyconreichen fermentierten Sojabohnen eine signifikant höhere Bioverfügbarkeit von Isoflavonen als glykosidreiche unfermentierte Sojabohnen hat.1
Miso ist ein traditionelles japanisches Produkt, das mit Sojabohnen, Reis und/oder Gerste, Salz und Schimmelpilzen fermentiert wird. Verschiedene Schimmelpilze verursachen die diversen Geschmacksrichtungen von Miso.
Soja basierende Säuglingsnahrung wird für Kleinkinder, die allergisch auf pasteurisierte Kuhmilch–Proteine sind, verwendet. Die US Food and Drug Administration (Nahrungs– und Arzneimittelzulassungsbehörde, FDA) hat die Sojanahrung als sicher für die Verwendung als die einzige Nahrungsquelle akzeptiert. Die Proteine, Öle und Kohlenhydrate können extrahiert werden um isolierte, medizinisch aktive, Isoflavone enthaltende Extrakte zu erhalten.
Siehe auch das kostenlose Online–Buch „Soybean and Health“ (Sojabohnen und Gesundheit) – von Hany El–Shemy bearbeitet.
1 Okabe Y, Shimazu T, Tanimoto H. Higher bioavailability of isoflavones after a single ingestion of aglycone–rich fermented soybeans compared with glucoside–rich non–fermented soybeans in Japanese postmenopausal women. Journal of the science of food and agriculture. 2011;91(4):658–663.
ROTKLEE (Trifolium pratense)
Rotklee, Trifolium pratense L., gehört zur Familie der Leguminosen (Fabaceae). Rotklee ist in Mitteleuropa häufig auf Wiesen und Feldern anzutreffen.
Es finden sich im Vergleich zu Soja-Bohnen, die reich an Genistein und Daidzein sind, im Rotklee vor allem andere Isoflavonarten, etwa Formononetin und Biochanin A.

Rotklee (Trifolium pratense)
 Soja ist eine subtropische Pflanze (bis zu 1.3 m hoch), die ein Bündel von 3–5 Schoten mit jeweils 2–4 Bohnen pro Schote bildet. Der botanische Name ist Glycine max. Der Gattungsname Glycine wurde erstmals von Carl von Linné in seiner ersten Auflage der „General Plantarum“ (Allgemeine Plantarum) von 1737 eingebracht. Das Wort Glycin wurde aus dem griechischen Wort „glykys“ (süß) abgeleitet und bezieht sich auf die Süße der birnenförmigen essbaren Knollen, die von der indianischen Hülsenfrucht hergestellt waren. Der wissenschaftliche Name: G. max (L.) Merrill wurde von Merrill im Jahre 1917 vorgeschlagen und wurde der offizielle Name für diese Nutzpflanze.
Soja ist eine subtropische Pflanze (bis zu 1.3 m hoch), die ein Bündel von 3–5 Schoten mit jeweils 2–4 Bohnen pro Schote bildet. Der botanische Name ist Glycine max. Der Gattungsname Glycine wurde erstmals von Carl von Linné in seiner ersten Auflage der „General Plantarum“ (Allgemeine Plantarum) von 1737 eingebracht. Das Wort Glycin wurde aus dem griechischen Wort „glykys“ (süß) abgeleitet und bezieht sich auf die Süße der birnenförmigen essbaren Knollen, die von der indianischen Hülsenfrucht hergestellt waren. Der wissenschaftliche Name: G. max (L.) Merrill wurde von Merrill im Jahre 1917 vorgeschlagen und wurde der offizielle Name für diese Nutzpflanze.
Sojabohne ist als große oder gelbe Bohne in der chinesischen und japanischen Sprache bekannt. Sowohl die unreife Sojabohnen, als auch Soja–Gerichte sind in Japan als “edamame” genannt. Der Gattungsname Glycine stammt aus der Aminosäure mit dem gleichen Namen. Die englischen Wörter „soy“ und „soya“ wurden aus der japanischen Aussprache von shōyu abgeleitet: das chinesisch–japanische Wort für Sojasauce (durch die deutsche Anpassung des gleichen Wortes, Soja).
Amerikanische und europäischen Männer weisen eine zehnfache Erhöhung des Prostatakrebsrisiko im Vergleich zu ostasiatischen Männern auf, teilweise wegen der Unterschiede im Konsumsniveau von Soja–Isoflavonen. Der Konsum von Soja–Produkten als Jugendlicher kann dazu beitragen Brustkrebs–Risiko als Erwachsener zu reduzieren. Soja kann auch helfen, das Risiko von Darmkrebs und Herzerkrankungen zu reduzieren.1
1 Kurosu M. Biologically Active Molecules from Soybeans, Soybean and Health, (Ed.), ISBN: 978-953-307-535-8, InTech, DOI: 10.5772/18950. Erhältlich von: http://www.intechopen.com/books/soybean-and-health/biologically-active-molecules-from-soybeans. 2011.
Sojabohnen enthalten Kohlenhydrate, Proteine und Fette, aber kein Cholesterin. Die Sojasprossen sind auch reich an Vitaminen, Mineralstoffen sowie Phytonährstoffen, Phytosterolen und Isoflavonen. Die wichtigsten Isoflavone sind Genistein, Glycitein, Daidzein und deren Abbauprodukt, Equol. Die Isoflavone sind für die medizinische Wirkung von Sojaextrakten verantwortlich.
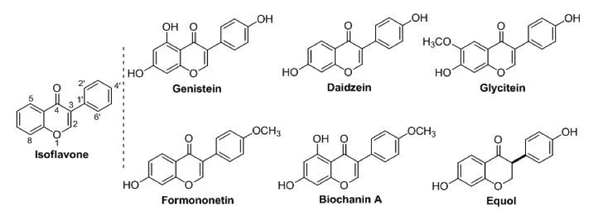
Abbildung 1: Soja enthält einige Isoflavone, die eine ähnliche Struktur haben. Die Haupt–Isoflavone in Soja sind Genistein, Daidzein und Glycitein (dementsprechend etwa 50, 40 und 10% des gesamten Isoflavon–Profils).1
Die höhere Zufuhr von Sojaprodukten, wie Bohnenquark oder Tofu in asiatischen Gesellschaften im Vergleich zu den westlichen Gesellschaften führt vermutlich zu geringerer Inzidenz von Wechseljahren–Hitzewallungen und bestimmter Tumoren. Diese Effekte sind der schützenden Wirkung von Genistein, Daidzein, Glycitein und Equol zuzuschreiben.
Isoflavone werden vor allem in Pflanzen aus der Klee Familie gefunden, in welcher Soja eine vorherrschende Spezies ist. Isoflavone sind jedoch nicht auf Soja oder Rotklee beschränkt. Sie sind auch in Sojaprodukten und anderen Hülsenfrüchten vorhanden. Sie sind nicht nur aus Luzerne – der asiatischen Pflanze kudzu isoliert, sondern auch aus Spezies, die in keinem Zusammenhang mit den Bohnen Familie stehen. Trockene Sojabohnen enthalten 1 bis 5 µg/g der Isoflavone.2,3
Sojasprossen
Sojasprossen werden aus den Sojabohnen durch einen relativ einfachen Prozess und in der gleichen Weise, wie Weizensprossen aus Weizen abgeleitet. Sojasprossen–Nährwertprofil ist ähnlich wie das von der ganzen Soja; jedoch werden mehrere Nährstoffe in höheren Mengen als in ganzen Sojabohnen, wie Tocopherole, Oligosaccharide, Phytosterole und geringfügig mehr Protein und Isoflavone gefunden. Das hohe Maß an Oligosacchariden in Sojasprossen wirkt als Präbiotikum (unterstützt probiotischen Wachstum).
Sojasprossen–Nahrungsergänzungsmittel können eine Alternative für diejenigen Frauen sein, die wenig Sojaprodukte über die Nahrung aufnehmen 4,5.
Sojaproteinisolate
Isolierte Protein–Verbindungen können aus Soja über eine Reihe von komplexen Verfahren gewonnen werden. Diese beinhalten Schälen, Schuppung und anschließend Sojabohnen–Entfettung durch die Extraktion mit Hexan. Die Protein– und Kohlenhydratteile werden dann getrennt und die Geschmacksverbindungen und Oligosaccharide entfernt. Zum Schluss werden die Proteine durch Alkali–Extraktion und Entfernung der Faser konzentriert. Ein Teil dieser Verarbeitung beinhaltet eine Säurewäsche in Aluminiumtanks, die zu unannehmbar hohen Aluminiumlevels in einigen Sojaprodukten führen können. Die Herstellung von Sojaproteinisolaten beinhaltet auch die Hochtemperaturverarbeitung, die die Proteine weitgehend denaturiert, was der Grund ihrer Nährwertsenkung ist.
Es hat sich gezeigt, dass die Sojaproteinisolate Hitzewallungen verringern und die Knochendichte verbessern.6,7 Allerdings ist die Wirkung von Soja–Präparate auf die Knochendichte und Knochenmineralumsatz immer noch kontrovers diskutiert.8–10
Die Vorteile von Isoflavone–enthaltenden Sojaproteinisolaten für das Herz–Kreislauf–System wurden in einer offiziellen gesundheitsbezogenen Angabe und einer Zufuhrempfehlung in den Vereinigten Staaten von Amerika angenommen.11 Die Erforschung der Lipidprofile ist im Detail widersprüchlich.12,13
Soja Extrakte
Soja Extrakte sind Zubereitungen, bei denen die Proteine oder Fett entfernt wurden. Ihr Inhalt und ihre relative Quantität der Isoflavone ist sehr nah oder identisch mit der typischen Soja–Lebensmittel, wie Tofu oder Sojamilch.14 Da sie nicht angereichert sind, können sie nicht als „Isolate“ oder „Konzentrate“ betrachtet werden.
Soja–Extrakte zeigten sich wirksam gegen Menopause–Hitzewallungen und andere Zuständen 15, mit langfristiger Sicherheit (mangelnde Proliferation von östrogenabhängigen Geweben).16
Nicht nur Frauen in der Menopause können von Isoflavon–Supplementation profitieren. Ein positives Ergebnis aus einer Studie, die die Verwendung von Soja–Isoflavonen Nahrungsergänzungsmittel auf Inzidenz der menstruellen Migräne bewertet, schlägt vor, dass eine östrogenartige Wirkung der Isoflavone die nachteiligen Auswirkungen der rückläufigen Östrogen während der Menstruationsphase des Zyklus moderieren kann.17 Außerdem zeigt die Erforschung von Prostatakrebsprävention die potenziellen Vorteile für Männer, die Isoflavon–Nahrungsergänzungsmittel nahmen.18–20
Isolierte Isoflavone
Einige synthetisch abgeleitete oder isolierte Isoflavone, wie Genistein und Equol werden für die Behandlung von Wechseljahrsbeschwerden und damit verbundenen Probleme empfohlen. Der Effekt gegen Hitzewallungen und auf den Knochenmineralumsatz wurde mit Zubereitungen, die isolierten Genistein20,21,22 und Equol23 enthalten, nachgewiesen. Die Sicherheit wurde sowohl in der eigenen Studien24–27, als auch in der Langzeitanwendung mit einer Dauer von bis zu drei Jahren gezeigt.
Quelle und weitere Informationen
Michio Kurosu (2011). Biologically Active Molecules from Soybeans, Soybean and Health, Prof. Hany El-Shemy (Ed.), ISBN: 978-953-307-535-8, InTech, DOI: 10.5772/18950. Biologically Active Molecules from Soybeans
Referenzen
1 Kurosu M. Biologically Active Molecules from Soybeans, Soybean and Health, (Ed.), ISBN: 978-953-307-535-8, InTech, DOI: 10.5772/18950. Available from: http://www.intechopen.com/books/soybean-and-health/biologically-active-molecules-from-soybeans. 2011.
2 Marini H, Bitto A, Altavilla D, et al. Breast safety and efficacy of genistein aglycone for postmenopausal bone loss: a follow-up study. The Journal of clinical endocrinology and metabolism. 2008;93(12):4787-4796.
3 Chen KI, Erh MH, Su NW, Liu WH, Chou CC, Cheng KC. Soyfoods and soybean products: from traditional use to modern applications. Applied microbiology and biotechnology. 2012;96(1):9-22.
4 Clerici C, Setchell KD, Battezzati PM, et al. Pasta naturally enriched with isoflavone aglycons from soy germ reduces serum lipids and improves markers of cardiovascular risk. The Journal of nutrition. 2007;137(10):2270-2278.
5 Imhof M, Gocan A, Imhof M, Schmidt M. Improvement of menopausal symptoms by soy isoflavones: A randomized, double-blind study. Planta Med. 2008;74 (9):928.
6 Arjmandi BH, Khalil DA, Smith BJ, et al. Soy protein has a greater effect on bone in postmenopausal women not on hormone replacement therapy, as evidenced by reducing bone resorption and urinary calcium excretion. The Journal of clinical endocrinology and metabolism. 2003;88(3):1048-1054.
7 Albertazzi P, Pansini F, Bonaccorsi G, Zanotti L, Forini E, De Aloysio D. The effect of dietary soy supplementation on hot flushes. Obstetrics and gynecology. 1998;91(1):6-11.
8 Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake increases bone mineral density in the spine of menopausal women: meta-analysis of randomized controlled trials. Clinical nutrition. 2008;27(1):57-64.
9 Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake inhibits bone resorption and stimulates bone formation in menopausal women: meta-analysis of randomized controlled trials. European journal of clinical nutrition. 2008;62(2):155-161.
10 Liu J, Ho SC, Su YX, Chen WQ, Zhang CX, Chen YM. Effect of long-term intervention of soy isoflavones on bone mineral density in women: a meta-analysis of randomized controlled trials. Bone. 2009;44(5):948-953.
11 Rimbach G, Boesch-Saadatmandi C, Frank J, et al. Dietary isoflavones in the prevention of cardiovascular disease–a molecular perspective. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association. 2008;46(4):1308-1319.
12 Taku K, Umegaki K, Sato Y, Taki Y, Endoh K, Watanabe S. Soy isoflavones lower serum total and LDL cholesterol in humans: a meta-analysis of 11 randomized controlled trials. The American journal of clinical nutrition. 2007;85(4):1148-1156.
13 Taku K, Umegaki K, Ishimi Y, Watanabe S. Effects of extracted soy isoflavones alone on blood total and LDL cholesterol: Meta-analysis of randomized controlled trials. Therapeutics and clinical risk management. 2008;4(5):1097-1103.
14 Anonymous. USDA Database for the Isoflavone Content of Selected Foods. Release 2.0. Beltsville, MD: Agricultural Research Service, US Department of Agriculture; 2008.
15 Amakura Y, Tsutsumi T, Sasaki K, Nakamura M, Yoshida T, Maitani T. Influence of food polyphenols on aryl hydrocarbon receptor-signaling pathway estimated by in vitro bioassay. Phytochemistry. 2008;69(18):3117-3130.
16 Palacios S, Pornel B, Bergeron C, et al. Endometrial safety assessment of a specific and standardized soy extract according to international guidelines. Menopause. 2007;14(6):1006-1011.
17 Burke BE, Olson RD, Cusack BJ. Randomized, controlled trial of phytoestrogen in the prophylactic treatment of menstrual migraine. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie. 2002;56(6):283-288.
18 Yan L, Spitznagel EL. Soy consumption and prostate cancer risk in men: a revisit of a meta-analysis. The American journal of clinical nutrition. 2009;89(4):1155-1163.
19 Travis RC, Allen NE, Appleby PN, Spencer EA, Roddam AW, Key TJ. A prospective study of vegetarianism and isoflavone intake in relation to breast cancer risk in British women. International journal of cancer. Journal international du cancer. 2008;122(3):705-710.
20 Hamilton-Reeves JM, Rebello SA, Thomas W, Kurzer MS, Slaton JW. Effects of soy protein isolate consumption on prostate cancer biomarkers in men with HGPIN, ASAP, and low-grade prostate cancer. Nutrition and cancer. 2008;60(1):7-13.
21 Crisafulli A, Marini H, Bitto A, et al. Effects of genistein on hot flushes in early postmenopausal women: a randomized, double-blind EPT- and placebo-controlled study. Menopause. 2004;11(4):400-404.
22 D’Anna R, Cannata ML, Atteritano M, et al. Effects of the phytoestrogen genistein on hot flushes, endometrium, and vaginal epithelium in postmenopausal women: a 1-year randomized, double-blind, placebo-controlled study. Menopause. 2007;14(4):648-655.
23 Ishiwata N, Melby MK, Mizuno S, Watanabe S. New equol supplement for relieving menopausal symptoms: randomized, placebo-controlled trial of Japanese women. Menopause. 2009;16(1):141-148.
24 McClain MR, Wolz E, Davidovich A, Bausch J. Genetic toxicity studies with genistein. Food Chem.Toxicol. 2006;44(1):42-55.
25 McClain MR, Wolz E, Davidovich A, Pfannkuch F, Edwards JA, Bausch J. Acute, subchronic and chronic safety studies with genistein in rats. Food Chem.Toxicol. 2006;44(1):56-80.
26 McClain RM, Wolz E, Davidovich A, Edwards J, Bausch J. Reproductive safety studies with genistein in rats. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association. 2007;45(8):1319-1332.
27 McClain RM, Wolz E, Davidovich A, Pfannkuch F, Bausch J. Subchronic and chronic safety studies with genistein in dogs. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association. 2005;43(10):1461-1482.
 Die Sojabohne (Glycine max) ist eine Spezies der Hülsenfrucht, die aus Asien stammt und wurde in den USA im Jahre 1765 von Samuel Bowen eingeführt. Der Gattungsname ‚Glycine‘ wurde zuerst von Carl von Linné in seiner ersten Auflage von General Plantarum (Allgemeine Plantarum) von 1737 eingeführt. Das Wort Glycin, vom griechischen Wort „glykys“ (süß), bezieht sich auf die Süße der birnenförmigen essbaren Knollen, die von indianischer Hülsenfrucht hergestellt waren. Der wissenschaftliche Name: G. max (L.) Merrill würde von Merrill im Jahre 1917 vorgeschlagen und bekam der offizielle Name für diese Nutzpflanze.
Die Sojabohne (Glycine max) ist eine Spezies der Hülsenfrucht, die aus Asien stammt und wurde in den USA im Jahre 1765 von Samuel Bowen eingeführt. Der Gattungsname ‚Glycine‘ wurde zuerst von Carl von Linné in seiner ersten Auflage von General Plantarum (Allgemeine Plantarum) von 1737 eingeführt. Das Wort Glycin, vom griechischen Wort „glykys“ (süß), bezieht sich auf die Süße der birnenförmigen essbaren Knollen, die von indianischer Hülsenfrucht hergestellt waren. Der wissenschaftliche Name: G. max (L.) Merrill würde von Merrill im Jahre 1917 vorgeschlagen und bekam der offizielle Name für diese Nutzpflanze.
Typische Soja abgeleiteten Lebensmittel, die relativ große Mengen an Isoflavonen enthalten, sind Sojabohnen, Sojasprossen, Sojamilch, Tofu, Miso, Natto und Tempeh.
In den fermentierten Lebensmitteln sind die Isoflavone überwiegend in ihrer Aglycon–Form vorhanden.
Soja basierende Säuglings Formel (SBSF) ist für die Kleinkinder verwendet, die allergisch gegen pasteurisierte Kuhmilch–Proteine sind. Die US Food and Drug Administration (Nahrungs– und Arzneimittelzulassungsbehörde, FDA) hat SBSFs für die Verwendung als einzige Nahrungsquelle als sicher akzeptiert.
Soja–Lebensmittel wie Miso, Natto und Tofu sind die Nahrungsgrundlage für einen Großteil der Weltbevölkerung. Eine geschätzte Zahl von 1.5 Milliarden Menschen hat einen lebenslangen, täglichen Kontakt mit Soja–Produkten. Wenn die Sicherheit von Soja–basierten Nahrungsergänzungsmitteln und deren Isoflavone diskutiert wird, muss die Ernährungssrfahrung nicht vergessen werden.
 Eine der wichtigsten Empfehlungen für Sojakonsum ist : so früh wie möglich damit anzufangen.
Eine der wichtigsten Empfehlungen für Sojakonsum ist : so früh wie möglich damit anzufangen.
Eine lebenslange Einnahme von Soja–Lebensmitteln scheint in asiatischen Gesellschaften mit einem niedrigeren Niveau von vielen chronischen Erkrankungen, inklusiv menopausalenHitzewallungen, Osteoporose, kardiovaskulären Erkrankungen und Krebs verbunden zu sein.
Soja kann auch von Vorteil bei Hauterkrankungen, Entzündungserkrankungen, Asthma, Gebrechlichkeit, bezüglich Kognition und zur Aufrechterhaltung eines gesunden Körpergewichts sein.
Symptome der Menopause
Sojasprossen und Isoflavone–Extrakte werden in Nahrungsergänzungsmittel verwendet, um Hitzewallungen zu lindern, und um gesunde Knochen und ein gesundes Herz–Kreislauf–System zu erhalten.
Soja und Brustkrebs
Die Verringerung des Risikos ist auf Veränderungen der Epigenetik, der Expression von Genen und der Zellproliferation und –Differenzierung zurückzuführen.1
Soja–Einnahme kann auch den Einfluss auf den Zeitpunkt der Menarche (erste Menstruation) haben. Der frühe Beginn der Pubertät kann gesundheitsschädliche Folgen haben. Bei Kindern mit der höchsten Aufnahme von pflanzlichem Eiweiß hat sich der Beginn verzögert, während bei derjenigen mit der höchsten Aufnahme von tierischem Eiweiß der Pubertätsbeginn bis zu 7 Monate früher war.
Außerdem können Mädchen mit hoher Isoflavonaufnahme etwa 7–8 Monate später den Beginn der Brustentwicklung und der Wachstumsgeschwindigkeitspitze erleben.
Höhere Aufnahme von Pflanzenprotein und Isoflavonen, wie auch eine niedrigere Aufnahme von tierischem Eiweiß kann zu einem niedrigeren Brustkrebsrisiko oder einer niedrigeren Gesamtsterblichkeit beitragen.2
Eine andere Studie ergab, dass eine frühe Menarche mit: niedrigem Geburtsgewicht, einer Teenager–Mutter, Erstgeborenen, schlechter Gesundheit oder mit einer Mutter, die raucht, assoziiert wurde (D’Aloisio et al., 2013).
Eine kürzlich durchgeführte Studie ergab, dass Soja keinen Einfluss auf das Alter des Menarchebeginns in amerikanischen Mädchen zu haben schien.3 Dies ist vielleicht nicht überraschend, da Östrogen die alpha–Rezeptoren stimuliert, die für die sexuelle Entwicklung von Mädchen verantwortlich sind. Soja stimuliert den beta–Rezeptor, der nur minimale Auswirkungen auf die sexuelle Entwicklung hat.
Referenzen
1 Hilakivi-Clarke L, Andrade JE, Helferich W. Is soy consumption good or bad for the breast? The Journal of nutrition. 2010;140(12):2326S-2334S.
2 Cheng G, Buyken AE, Shi L, et al. Beyond overweight: Nutrition as an important lifestyle factor influencing timing of puberty. Nutrition Reviews. 2012;70(3):133-152.
3 Segovia-Siapco G, Pribis P, Messina M, Oda K, Sabate J. Is soy intake related to age at onset of menarche? A cross-sectional study among adolescents with a wide range of soy food consumption. Nutrition journal. 2014;13:54.
 Die typische Tagesdosis beträgt für einen Sojaextrakt 45-90 mg Isoflavone.
Die typische Tagesdosis beträgt für einen Sojaextrakt 45-90 mg Isoflavone.
Dieser Bereich kann als wirksam und sicher angesehen werden.
 EFSA bestätigt – Isoflavone sind für peri- und postmenopausale Frauen sicher!
EFSA bestätigt – Isoflavone sind für peri- und postmenopausale Frauen sicher!
Der im Oktober 2015 publizierte wissenschaftliche Meinung der EFSA (Europäische Behörde für Lebensmittelsicherheit) bestätigt, dass es keine Hinweise auf negative Wirkungen von Isoflavonen aus Nahrungsergänzungsmitteln auf das Brust- bzw. Gebärmuttergewebe sowie die Schilddrüsenhormone gibt. Insgesamt flossen über 100 Studien in die Risikobewertung mit ein. In den Studien wurden Dosierungen zwischen 35-150 mg Isoflavone pro Tag über einen Zeitraum von drei Monaten bis 30 Monaten eingesetzt. Der Fokus der Bewertung lag ausschließlich auf Frauen in den Wechseljahren. Daten zu Männerstudien oder Säuglingsnahrung auf Sojabasis fanden keine Berücksichtigung.
Die Ergebnisse im Detail:
- Brust: Es gab keine Indizien für ein erhöhtes Brustkrebsrisiko. Bei der Mammografie kam es zu keiner erhöhten Gewebedichte und auch andere Marker wurden nicht beeinflusst.
- Gebärmutter: Bei bis zu 30-monatiger Supplementierung von 150 mg Sojaisoflavonen proTag wurden keine Veränderungen festgestellt.
- Die Schilddrüsenhormonspiegel blieben nach der Aufnahme von Isoflavonen aus Nahrungsergänzungsmitteln unverändert.
- Eine Schädigung des Erbmaterials wurde ausgeschlossen.
Die Ergebnisse der EFSA zeigen einmal mehr, dass isoflavonhaltige Nahrungsergänzungsmittel sicher sind – auch bei Langzeiteinnahme.
Quelle: EFSA ANS Panel; EFSA Journal 13(10): 4246–4588; 2015.
Link zur Originalpublikation: http://www.efsa.europa.eu/en/efsajournal/pub/4246
————————————————————-
Das japanische Gesundheitsministerium führte eine 50 Jahre–Umfrage mit Daten von rund 20.000 Personen aller Altersklassen.1
Typischer Soja–Konsum liegt im Bereich von 65 g pro Tag, mit höheren Aufnahmen bei älteren Menschen (91.7 g pro Tag in der Altersgruppe: 60–69 Jahre). Berechnet als Aglykone, die durchschnittliche Exposition gegenüber Isoflavone liegt bei 26–54 mg pro Tag. Diese variiert je nach Standort: in Japan es ist höher als in der mehr verwestlichten Hongkong oder Singapur. In bestimmten Gebieten in China die tägliche Exposition erreicht 76 mg pro Tag, und wurde mit einem reduzierten Risiko von Prostatakrebs in Verbindung gebracht.1,2
Eine Subpopulation von bis zu 10% des regulären Soja Verbraucher (150 Millionen Menschen) hat eine geschätzte tägliche Einnahme von etwa 100 mg Isoflavone, als Aglykone berechnet.1
Es gibt deutliche Unterschiede zwischen den Arten von Sojaprodukten, die für das Management von menopausalen und post–menopausalen Beschwerden zur Verfügung stehen. Einige dieser Produkte sind so hoch–verarbeitet, um die isolierten Verbindungen zu erhalten, dass sie in keiner Weise die ursprünglichen Sojabohnen von denen sie abgeleitet wurden ähneln.
Die gesundheitlichen Vorteile und Risiken solcher Produkte werden daher in einem anderen Licht im Vergleich zu Soja gezeigt, die als Teil der Ernährung konsumiert wird.
Ganze Soja enthält Isoflavone, Phytosterole, Saponine, Faser, Oligosaccharide, Lecithin, Tocopherol und andere Vitamine.
Um alle gesundheitlichen Vorteile von Soja, wie die Verbesserung der Knochendichte, die kardiovaskuläre Gesundheit und Verringerung der Menopause–Hitzewallungen zu erreichen, kann es notwendig sein, die Nahrungsergänzungsmittel, die so nah an ihrer Nährwertprofil wie möglich sind, zu konsumieren.
Studien der klinischen Wirkungen und die Anwendungssicherheit existieren mittlerweile für Soja–Lebensmittel und Sojaextrakten, sowie für die isolierten Isoflavone – inklusive bis zu drei Jahre Langzeitstudien. Bisher keine der Studien die Gründe zur Sorge zeigte, auch bei hohen Dosen der Isoflavone, die normalen diätetischen Einlass überschreiten.3
Soja hat zellschützende Wirkung
Die Sicherheit von Isoflavonen in hormonsensitiven Geweben wie Brust, Gebärmutter und Vaginalepithel wurde explizit im klinischen Umfeld, in epidemiologischen und in Fall–Kontroll– und Kohortenstudien untersucht. Die bisher vorhandenen Daten unterstützen vorteilhafte Wirkungen von diätetischen Isoflavonen auf die Gesundheit von Frauen, und die Abwesenheit der Sicherheitsaspekte auf langfristige Nutzung auch in Dosisbereichen, die nicht durch die Verschiebung der Ernährungsgewohnheiten auf Soja–reiche Nahrung zu erwarten sind.
Viele Studien zeigen einen Zusammenhang zwischen Isoflavonaufnahme und einer Reduktion der Inzidenz von Krebserkrankungen, während andere Studien konzentrieren sich auf das Fehlen der krebserregenden Eigenschaften. Keine der Studien zeigten eine höhere Inzidenz von Krebs, die mit einer höheren Zufuhr von Isoflavonen in Zusammenhang stand: die Mehrzahl von Datenpunkten entsprach einer schützenden Wirkung.
Im Gegensatz dazu hat sich auch gezeigt, dass die Annahme einer westlichen Ernährung das Risiko von Brustkrebs bei Frauen nach der Menopauseerhöht . Eine Studie untersuchte solche Frauen in der Shanghai Breast Cancer Study. Die Studie fand heraus, dass die westliche Ernährung erhöht das Brustkrebsrisiko bei postmenopausalen chinesischen Frauen.4
Andere Studien haben festgestellt, dass Soja und Isoflavone schützend gegen eine Reihe von anderen Krebsarten, einschließlich Blasenkrebs, Magen–Darm–Krebs, Lungenkrebs, multiples Myelom, Nasen–Rachen–Krebs, Non–Hodgkin–Lymphom und Schilddrüsenkrebs sind.
Männliche Fruchtbarkeit
Bedenken wurde auch zu Sojaaufnahme und männlicher Fruchtbarkeit angehoben. Dies ist unbegründet. Die Ergebnisse einer Meta–Analyse der klinischen Studien zeigen, dass Soja–Proteine oder Isoflavone keine Auswirkung auf die Fortpflanzungshormone bei Männern haben.
Die Fähigkeit von Isoflavonen, die östrogenähnlichen Wirkungen bei Männern durch Absenken bioverfügbarem Testosteron ausüben, wurde durch die Auswirkungen von Soja–Proteinen– oder Isoflavonaufnahme aufs Testosteron, Sexualhormon–bindendes Globulin (SHBG), freies Testosteron und freien Androgen–Index (FAI) bei Männern ausgewertet.
In englischer Sprache veröffentlichte Peer–Review–Studien wurden ausgewählt, wenn:
[1] erwachsene Männer Soja–Lebensmitteln, isoliertes Sojaprotein oder Isoflavon–Extrakten (aus Soja oder Rotklee) konsumiert haben und
[2] zirkulierendes Testosteron, SHBG, freies Testosteron oder berechneter FAI beurteilt wurde.
Die Daten wurden von zwei unabhängigen Gutachtern extrahiert. Isoflavone–Exposition wurde direkt von Studien entzogen.
Fünfzehn Placebo–kontrollierten Behandlungsgruppen mit der Grundlinie und den End–Maßnahmen wurden analysiert. Darüber hinaus wurden 32 Berichte mit 36 Behandlungsgruppen in einfacheren Modellen bewertet, um die Ergebnisse zu ermitteln.
Keine wesentlichen Auswirkungen von Soja–Proteinen– oder Isoflavonaufnahme auf Testosteron, SHBG, freies Testosteron oder FAI wurden unabhängig vom statistischen Modell gefunden. Die Ergebnisse dieser Meta–Analyse schlagen vor, dass weder Soja–Lebensmittel noch Isoflavonen–Nahrungsergänzungsmittel die Konzentrationen des bioverfügbaren Testosteron bei Männern verändern.5
Schilddrüsensicherheit
Da ist auch eine Menge von Anti–Soja–Propaganda im Internet über den „gefährlichen Effekt“ von Soja auf die Schilddrüse. Wenn Soja so eine nachteilige Wirkung auf die Schilddrüse hätte, wurden auch viele Fallberichten veröffentlicht. Jedoch gibt es nur zwei klinische Fallberichte, die auf eine mögliche Auswirkung von Soja–Nahrung auf die Absorption von Levothyroxin bei Neugeborenen hindeuten.
Forscher berichteten den Fall von zwei Patienten mit angeborenen Hypothyreose, die weiterhin die klinischen Hypothyreose, während der Behandlung mit der empfohlenen Dosis des Hormons und mit der Einnahme von Soja–Produkten manifestierten.6
Der Fall der beiden Patienten weist auf eine mögliche Störung von Sojaprodukten mit Levothyroxin Absorption bei Säuglingen hin, welche bei Säuglingen mit angeborener Hypothyreose, die mit einem Risiko für Entwicklungs– und Wachstumsverzögerung sind, offensichtlich werden kann.
Dieser Zustand bei Säuglingen ist nicht auf Frauen in der Menopause oder auch auf die allgemeine Bevölkerung übertragbar, sonst würden Schilddrüsenerkrankungen bei jedem auf Soja–Produkte ausgesetztem Patient und bei jedem mit Levothyroxin auftreten.
Veröffentlichte klinische Daten deuten darauf hin, dass die Aufnahme von Isoflavonen entweder keine oder nur geringe Auswirkungen auf das Niveau der Schilddrüsenhormone hatten.7–10
Isoflavone erhöhen kein Risiko einer klinisch relevanten niedrigen Schilddrüsenfunktion. Jodmangel ist jedoch ein bekannter Risikofaktor für Hypothyreose. Vor allem bei Frauen in den Wechseljahren sollte eine ausreichende Versorgung mit Jod, unabhängig von der Einnahme von Soja–Produkte gefördert werden.11
Eine der letzten Literaturrecherchen analysierte die verfügbaren klinischen Daten und kam zu dem Schluss, dass auch „Erwachsene mit Hypothyreose keine Soja–Lebensmittel vermeiden müssen. Darüber hinaus besteht ein theoretisches Anliegen, dass auf in vitro und Tierdaten basiert, dass bei Personen mit eingeschränkter Schilddrüse–Funktion und/oder bei denen mit marginaler Jodzufuhr, Sojaprodukte das Risiko der klinischen Hypothyreose Entwicklung erhöhen können. Daher ist es wichtig, dass die Soja–Lebensmittel–Verbrauchern sicherstellen, dass ihre Aufnahme von Jod angemessen ist.12 Weitere klinische Daten, nicht in der Literaturrecherchen von Messina et al (2006) enthalten, sind verfügbar.13–16 Keine dieser Studien deutet auf einen negativen Einfluss von Isoflavonen auf Schilddrüsenumsatz hin. Die klinische Studie von Imhof et al. (2008) enthielt ebenfalls Messungen von Schilddrüsenhormonen (TSH, T3 und T4) bei postmenopausalen Frauen. Keine Auswirkung der Sojaextrakt–Supplementierung mit 100 mg Isoflavonen pro Tag (berechnet als Glykoside) wurde nach 12 und 24 Wochen gefunden.17,18
Entwicklung des Säuglings
Langzeiternährung eines ready–to–eat Soja–Formel hat keine Unterschiede im Wachstum, in der Entwicklung, der Knochendichte und im Inhalt der Serum Mineralien im Vergleich zu einem Kuh–Milch basierenden Formel in einer Studie mit 51 gesunden Reifgeborenen über drei Jahre gezeigt.19
Eine andere Studie zeigte, dass in Bezug auf Entwicklung es keinen Unterschied macht, ob ein Säugling mit Milch oder Soja–basierenden Formel ernährt wird.20
Östrogen
Das Hormon Östrogen ist ein wichtiger Regulator des Wachstums und der Differenzierung in einer Vielzahl von Geweben, einschließlich die Brust, das reproduktive Zentralnervensystem und Skelettsystem. Östrogen ist auch bekannt, bei Brust– und Gebärmutterschleimhautkrebs beteiligt zu sein.21
Dies hat zu einem Anliegen geführt, dass die Verbindungen mit ähnlichen Strukturen zu Östrogen, die in Pflanzen gefunden sind, ähnliche Effekte haben können.
Phytoöstrogene oder „Pflanzenhormone“
Es ist seit langem bekannt, dass Pflanzen die Stoffe produzieren können, die hormonellen Wirkungen bei Menschen hätten. Ein wichtiges Beispiel ist, dass die Frauen, die Hopfen zum Bierbrauen sammeln, die Anomalien in ihren Menstruationszyklus erleben können. Hopfen ist auch als ein Mittel gegen dem sexuellen Verlangen bei Mönchen im Mittelalter verwendet worden. Noch heute ist das Wachstum der männlichen Brust eine bekannte Folge des übermäßigen Biertrinkens, das mit in Hopfen gefunden Östrogen–ähnlichen Bestandteilen zugeordnet werden kann.22
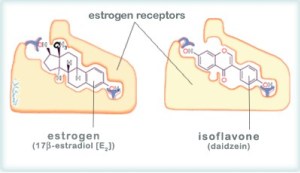
Dies hat das Bedenken hinsichtlich der potentiellen hormonähnlichen Wirkung von Soja–Isoflavonen angehoben. Wie in Abbildung 1 gezeigt, Genistein hat eine ähnliche Struktur wie die verschiedenen Östrogen Subtypen. Die Überlegung ist erhoben worden, dass so genannte Phyto–“Östrogene“ auch das Wachstum vom hormonsensitiven Krebs in der gleichen Weise wie Östrogen erzeugen könnten.23,24
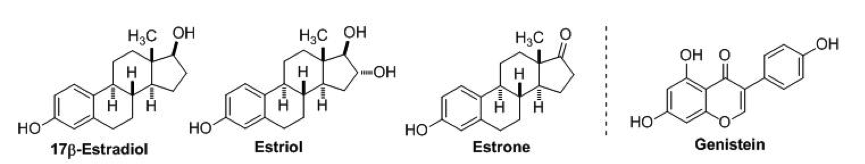
Abbildung 1: Das Isoflavon Genistein hat eine sehr ähnliche, aber nicht identische Struktur zu Östrogen (Östradiol, Östriol und Östron).21
Auf den ersten Blick gibt es Tier–24–28 und Laborstudien29,30, die auf solche Bedenken zu bestätigen scheinen. Es ist gezeigt worden, dass Soja–Isoflavone an Östrogen–Rezeptoren wirken, was darauf hindeutet, dass die die Zellproliferation in hormonsensitiven Geweben wie Brust oder Gebärmutter auslösen sollten.
Die Bedeutung solcher Untersuchungen ist jedoch gemeinsam mit der überwiegenden Menge von anderen Studien, einschließlich die epidemiologischen und klinischen Studien an Menschen, die nicht nur die Sicherheit von Isoflavonen bestätigen, sondern auch die gegenteilige Wirkung zeigen, ausgewertet werden: Soja–Isoflavone schützen gegen Hormon–ausgelösten Krebs.
Humanstudien zeigen deutlich, dass das potenzielle in Tier– und Laborstudien beobachtete Risiko kann nicht direkt auf den Menschen übertragen werden.
Die Dosis der in Tierstudien angewendeten Isoflavone, die vermutlich ein Risiko zeigten, war in der Regel in einem Bereich weit über dem, was durch Verzehr von Soja–Lebensmitteln oder –Nahrungsergänzungsmittel31,32 erreicht werden kann. Auch die Art, in der Isoflavone in Nagetieren verarbeitet werden, ist höchst unterschiedlich zu den Mechanismen der Absorption, Verteilung und Bioverfügbarkeit bei Menschen.33 Das menschliche Hormonsystem ist auch wesentlich komplexer als die Tiermodellen.
Heutzutage ist die Aufnahme von Soja–Isoflavonen als besonders vorteilhaft für viele Aspekte der menschlichen Gesundheit angesehen.34
Der Begriff „Phytoöstrogen“ – wortwörtlich: eine Pflanzen–stammende Verbindung, die sich wie Östrogen verhaltet und den Östrogenrezeptor aktivieren kann – wurde geprägt, um diese Gruppe von Substanzen zu beschreiben, die in einer Vielzahl von Getreide, Samen, Hülsenfrüchten und Heilpflanzen, sowie einigen anderen häufig gegessenen Lebensmitteln gefunden sind.
Dieser Begriff wurde nach einer Beobachtung geprägt, dass die Schafbeweidung auf Rotklee die Unfruchtbarkeit entwickelt.35
Es war ursprünglich davon angenommen, dass die Phytoöstrogene aus Rotklee leistungsstarke, aufgrund ihrer hormonellen Effekte als Verhütungsmittel–wirkende Östrogene sind.35 Es stellte sich heraus nicht zutreffend zu sein.
Das Rätsel der Unfruchtbarkeit von weidenden Schafen ist immer noch ungelöst. Es kann die Unterschiede im Stoffwechsel von Schafen und anderen Säugetieren in Beziehung gesetzt werden, aber es kann auch mit der Schuld den falschen Kräuter verwandt sein.
Östrogen–Rezeptoren
Es ist nicht so lange her, als die Forscher festgestellt haben, dass wir nicht nur einen Östrogen–Rezeptor, sondern zwei: Alpha und Beta haben.36 Diese beiden Rezeptoren steuern sich gegenseitig. Zum Beispiel wenn Alpha–Rezeptoren die Zellproliferation hervorrufen, haben Beta–Rezeptoren in parallel die antiproliferativen Wirkungen.
Der Östrogen–Rezeptor–α (ÖRα) wurde in der inneren Membran des Uterus (Endometrium) und Brustkrebszellen gefunden. Anderseits wurde ÖRβ in Nieren, Gehirn, Knochen, Herz, Lunge, Darmschleimhaut, Prostata– und Endothelzellen gefunden.21
Wahres Östrogen ist ein starker Stimulator des alpha–Rezeptors und wird die Proliferation von diesen Geweben und damit das Problem von Östrogen in hormonsensitivem Krebsarten verursachen. Soja hat fahrlässige Wirkung auf die alpha–Rezeptoren.37,38 Die Aktivierung des alpha–Rezeptors würde zehnfach höherere Blutwerte erfordern als das, was durch die Aufnahme von Isoflavonen erreicht werden kann.39,40
Die Begriffe Phyto–Östrogen und Pflanzenhormon haben eine Menge Verwirrung verursacht.
Die Verwendung dieser Begriffe sollte fallengelassen werden und durch die viel genauere Bezeichnung: Selektiver Östrogenrezeptor–Modulator SÖRM ersetzt werden. Dies liegt daran, dass Soja–Isoflavone selektiv den beta–Rezeptor und nicht den alpha–Rezeptor stimulieren. Soja–Isoflavone sind SÖRMs mit einer Präferenz für den beta–Rezeptor.
Es ist die Stimulation des alpha–Rezeptors, der für die sekundären Geschlechtsentwicklung und Brüste in Mädchen in der Pubertät verantwortlich ist. Sojakonsum in dieser Zeit verbessert die Differenzierung von Brustgewebe durch Stimulierung des beta–Rezeptors, was zu einer Reduktion des lebenslangen Risiko von Brustkrebs führt.41
Die Stimulation des alpha–Rezeptors durch Genistein liegt nur bei 4% der Wirkung des am meisten potenten Östrogen – Estradiol. Im Gegensatz dazu liegt die Affinität für den beta–Rezeptor bei 87%.42
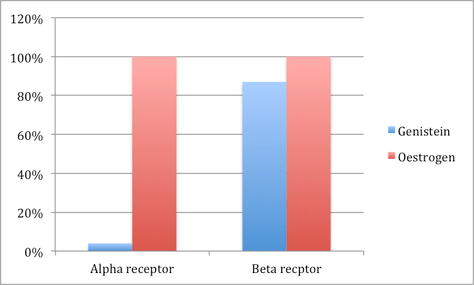
Abbildung 2: Soja–Isoflavone sind Selektive Östrogenrezeptor–Modulatoren (SÖRMs) mit einer sehr starken Affinität für den beta–Östrogen–Rezeptor und einer sehr geringen Affinität für den alpha–Rezeptor.
Isoflavone sind besonders wichtig für Frauen und sind dafür bekannt, den Menstruationszyklus zu beeinflussen43, um das Auftreten von Östrogen ansprechenden Krebserkrankungen zu reduzieren44,45 und die Frequenz und die Schweregrad der Symptome der Menopause zu verringern.46,47
Frauen, die eine an Phytoöstrogenen reiche Ernährung haben, haben ein geringeres Risiko von Brustkrebs im Vergleich zu den Frauen mit einem geringen Verzehr von Soja und Hülsenfrüchte.48 Die regelmäßig in den asiatischen Ländern konsumierten Soja–Produkte enthalten reichliche Mengen von Isoflavonen49 und sollen für diese positiven Effekte verantwortlich sein50, obwohl auch andere in Soja–Produkten enthaltenden Faktoren auch Anti–Krebs und andere vorteilhafte Effekte haben.
Im Gegensatz zu Estradiol (das wahre Östrogen–Hormon) können keine der Phytoöstrogene das gesamte Spektrum der östrogenen Aktionen aufgrund der geringen Stimulationsfähigkeit des alpha–Rezeptors auslösen. Also beispielsweise physikalische Reifung, Eisprung und Menstruation – die typisch alpha–Rezeptor–verbundenen Effekte – können nicht als Reaktion auf Isoflavone auftreten.
Eine Studie über die langfristigen Auswirkungen von Soja–Formel für Säuglinge hat gezeigt, dass im Erwachsenenalter gab es keine signifikanten Entwicklungs– oder Fortpflanzungs– Unterschiede zwischen Kindern, die mit Soja–Formel und derjenigen, die mit Kuhmilch Formel gefüttert wurden.51
Forschung entwickelt sich auf vielen Effekten von Phytoöstrogenen, einschließlich ihre nicht–hormonelle Aktionen auf täglicher Basis. Auf der Grundlage von bisherigen Befunden scheint es realistisch vorzuschlagen, dass Frauen aller Altersgruppen im Rahmen einer ausgewogenen Ernährung die Phytoöstrogene regelmäßig verbrauchen. Es ist möglich, dass das größtmögliche Nutzen gewonnen werden kann, wenn die Exposition gegenüber Phytoöstrogene früh im Leben, vor der Pubertät beginnt (Warri et al. 2008). Allerdings die klinischen Daten bieten genügend Beweise, dass auch Frauen nach der Menopause ohne vorheriger bemerkenswerter Exposition gegenüber Isoflavone von einer erhöhten Aufnahme durch eine verbesserte Gesundheit der Knochen und weniger Wechseljahrsbeschwerden profitieren werden.46,52
Sicherheitshinweise mit Krebsmedikamenten
Tamoxifen
Es gibt keine klinischen Hinweise darauf, dass Isoflavone Brustkrebs fördern, oder dass die Exposition gegenüber Isoflavonen mit einer klinisch nachgewiesen lebensverlängernden Wirkung bei Brustkrebs–Patientinnen zugeordnet ist.53
Brustkrebs ist eine der häufigsten Krebsarten in westlichen Industrieländern. Mit der aktuellen Therapie ist die Fünf–Jahren–Überlebensrate relativ hoch, mit 89%.54 Jedoch bei 10–15% der Frauen wird das Wiederauftreten vom Krebs innerhalb von drei Jahren beobachtet. Die Anti–Östrogen–Medikament Tamoxifen wird verwendet, um das Risiko eines erneuten Auftretens zu reduzieren, aber zwei drittel der mit Tamoxifen behandelten Frauen leiden unter typischen Wechseljahrsbeschwerden, wie Hitzewallungen oder nächtliche Schweißausbrüche, die durch Ovarialinsuffizienz innerhalb des ersten Jahres der Behandlung von Krebs verursacht sind.55 Einige Autoren haben ihre Besorgnis bezüglich der Sicherheit des Konsums von Phytoöstrogenen bei Frauen mit Brustkrebs, insbesondere im Zusammenhang mit der Behandlung mit Tamoxifen zum Ausdruck gebracht. Langzeitstudien mit Isoflavon–Exposition gegenüber gesunden und krebstragenden Frauen unterstützen keine solche Bedenken.11,56–58 Tatsächlich, Soja–Lebensmitteln und Isoflavone Exposition gegenüber Frauen mit Brustkrebs, einschließlich die Frauen, die mit Tamoxifen behandelt wurden, wurde gezeigt, die Prognose der Erkrankung zu verbessern.59
Die Forscher beobachteten die Verbindung von Sojanahrungsaufnahme nach der Diagnose von Brustkrebs mit Gesamtmortalität und Wiederauftreten von Krebs, als auch mit Wechseljahrsbeschwerden. Ihre Ergebnisse wurden auf der Shanghai Breast Cancer Survival–Studie, einer Großpopulation–Kohortenstudie mit 5042 Frauen mit Brustkrebs basiert.60 Die Studie umfasste die Beurteilung der Auswirkungen von Soja–Exposition auf die Wiederkehr, Sterblichkeit, Lebensqualität, Knochenverlust, Depressionen, kognitive Abnahme, Herz–Kreislauf–Erkrankungen und Histopathologie des Brustgewebes. Die Forscher fanden heraus, dass Soja Nahrungsaufnahme, die als Soja–Proteine und/oder Soja–Isoflavone Aufnahme gemessen wurde, wurde umgekehrt mit Mortalität und Wiederauftreten von Krebs korreliert.61 Die Hazard–Ratio, die mit der höchsten Quartil der Soja–Protein–Aufnahme zugeordnet wurde, betrug 0.67 (95% CI 0.52–0.84) für erneuten Auftretens gegenüber dem untersten Quartil. Die multivariant angepassten Sterberaten waren 13.1 und 9.2%, und die Fünf–Jahren–Rückfallraten waren 13.0 und 8.9% jeweils für Frauen in der niedrigsten und höchsten Quartil der Soja–Protein–Aufnahme. Höhere Isoflavone Exposition von Brustkrebs–Patientinnen hat deutlich die Prognose verbessert.
Die verbesserte Prognose zeigte sich bei Frauen mit Östrogen–negativem und positivem Brustkrebs, und wurde auch bei Anwendern und Nicht–Anwendern von Tamoxifen gefunden. Soja–Proteine und Isoflavone wurden mit der Zeit des krankheitsfreien Überlebens korreliert. Die besten Wirkungen wurden mit etwa 11 g Sojaprotein täglich oder mit 30–70 mg Isoflavone festgestellt. Es gab keinen Unterschied bezüglich prä– oder postmenopausalen Frauen.
Es gab auch keine Wertminderung der Krebstherapie in großen Fallkontrollstudien.60,62 In einer Kohortenstudie 1954 der Brustkrebs–Patienten im Jahr gab es nicht nur einen ermäßigten Satz von Krebs Wiederholung, aber auch keine unerwünschte Wechselwirkung mit Tamoxifen.47 Die Studie erwähnt explizit positive Effekte gegen Östrogenrezeptor–positivem Brustkrebs und damit gegen eine Form von Krebs, die sehr empfindlich auf Östrogenen durch Wachstumsstimulation reagiert.47
Anastrozol
Frauen nach der Menopause bevorzugen den Aromatase–Hemmer Anastrozol oberhalb Tamoxifen, weil er die Produktion von Östrogen im Fettgewebe blockiert. Forschung schlägt auch vor, dass Soja sicher für die Frauen oder Männer ist, die mit Anastrozol behandelt wurden. In einer kürzlich veröffentlichten Studie beobachteten die Forscher einen Zusammenhang zwischen der Soja–Isoflavone Aufnahme und Brustkrebs Wiederauftreten und der Überlebensrate bei 524 postoperativen Brustkrebspatientinnen, die eine Hormonbegleittherapie erhielten. Isoflavonaufnahme wurde eindeutig mit einer statistisch signifikanten Reduktion des Risikos eines Brustkrebs–Wiederauftreten assoziiert.63,64 Die Ergebnisse der Studie widersprechen der Hypothese eines erhöhten Brustkrebsrisiko bei Frauen in der Menopause. Sie deuten auf einen potentiellen Synergismus der Isoflavoneffekte mit der Wirksamkeit von Krebsmedikamenten, wie beispielsweise Anastrozol hin.
Soja–Allergie
Seit 1910 Soja basierenden Formulierungen haben das Leben vieler Säuglinge gerettet, deren Mütter nicht stillen konnten und die allergisch auf Kuhmilch waren.
Trotz der vorherrschenden Ansicht, dass Soja–Allergie ein großes Problem ist, ist das dokumentierte Niveau der Sojaallergie tatsächlich sehr gering in Europa und in Asien. Die am häufigsten berichteten Nahrungsmittelallergene in den europäischen und nordamerikanischen Länder sind Kuhmilch, Eier, Erdnüsse, Nüsse, Weizen, Krebsschalentiere, Fisch und Soja. Allerdings die tatsächliche Verbreitung von Fisch und Soja–Allergien sind niedrig in Challenge–Studien.
Die Verbreitung von Arzt diagnostizierter Sojaallergie stellte fest, dass die nur bei 2 von 1000 (0.2%) Jährigen und in 8 von 1000 (0.8%) 4– und 8–Jährigen in Schweden beobachtet wurde. Sensibilisierung auf der Grundlage eines positiven Hautsticheltests erwies sich als 8.3% einer ungarischen Untersuchung der 20 bis 69–Jährigen, aber nur als 0.2% der siebenjährigen Kindern in Großbritannien. Wenn eine überzeugende Geschichte mit Sensibilisierung kombiniert wurde, reichte die Prävalenz der Sojaallergie von 0% bei der 18–monatigen schwedischen Kindern auf 1.6% der 4–Jährigen, auch aus Schweden. Nur eine Studie führte eine doppelblinde, placebokontrollierte Nahrungsmittel–Challenge durch und berichtete 0% Sojaallergie–Prävalenz in 0 bis 22–Jährigen.65
Milch oder Milchprodukte sind die häufigsten Lebensmittelallergien in Europa und weltweit. Die selbstberichtete Milchallergie betrug 21% in einer Studie. Die höchsten Raten der Challenge–erprobten Kuhmilchallergie lag bei 2.3% (95% CI: 1.5–3.3%) in einer niederländischen Studie von Kleinkindern.65
Die Gesamtprävalenz der Nahrungsmittelallergie in Asien ist ein wenig vergleichbar mit dem Westen. Allerdings die Arten von Nahrungsmittelallergie unterscheiden sich in der Reihenfolge ihrer Relevanz. Schalentier ist das häufigste Allergen aus Asien, zum Teil aufgrund des Reichtums von Meeresfrüchten in dieser Region. Die Erdnuss–Allergie in Asien ist extrem niedrig im Vergleich zum Westen aus noch nicht verstandenen Gründen. Bei jungen Kindern und Säuglingen, Ei und Kuhmilch–Allergie sind die beiden häufigsten Nahrungsmittelallergien, mit Prävalenzdaten, die vergleichbar mit der westlichen Bevölkerung sind. Sojaallergie scheint niedrig in den asiatischen Ländern zu sein.66
Phytinsäure
Vieles wird im Internet über das „Gefahren“ von Phytinsäure in Sojaprodukten geschrieben. Phytinsäure (auch als Inositolhexaphosphat (IP6) oder Phytat bekannt) ist in der Kleie und Hülse der meisten Getreide, Bohnen, Nüsse und Samen vorhanden. Weizenkleie und Leinsamen sind reich an Phytinsäure. Phytinsäure bindet an Mineralen und Metallen. Daher kann sie die Körper–Aufnahme der wesentlichen Mineralien, wie Magnesium, Calcium und Eisen blockieren. Andererseits ist Phytinsäure ein Antioxidans und hat Anti–Krebs–Eigenschaften. Phytinsäure verbessert auch die Entfernung von Schwermetallen wie Blei und anderen toxischen Metallen aus dem Körper.21
Phytinsäure Mengen sind am höchsten in eingeweichten Sojabohnen und am niedrigsten in fermentierten Produkten wie Tempeh. Der Phytinsäureinhalt von eingeweichten Sojabohnen wurde während der Tempeh–Fermentation halbiert und weiter reduziert, wenn Tempeh für 72h bei 5°C und 30°C gelagert wurde. Frittieren von Tempeh in Erdnussöl halbiert weiter den Phytinsäureinhalt. Weniger als 10% der Phytinsäure blieb nach Tempeh–Fermentierung, Lagerung und Braten (siehe die Abbildung unten).67
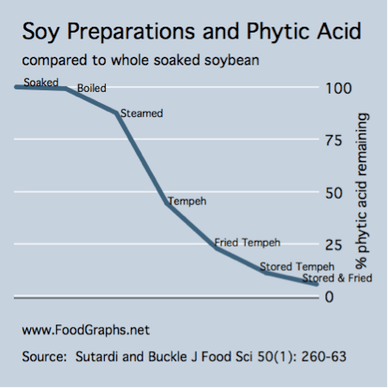
Abbildung 3: Tempeh hat das niedrigste Niveau der Phytinsäure, während eingeweichten Bohnen den höchsten.
Ob Phytinsäure mit Mineralabsorption interferiert?
Eine Studie untersuchte die Wirkung vom Kochen auf den Inhalt von Phytat und die hemmende Wirkung von Phytat auf die Bioverfügbarkeit der Mineralien in acht malaysischen Sojagerichten. Die Studie ergab, dass das Kochen den Phytatinhalt reduzierte, aber es war nicht signifikant unterschiedlich (p> 0.05). Die Studie fand auch, dass Phytat die Bioverfügbarkeit von Kalzium und Eisen, aber nicht Zink aus der Lebensmittel reduziert.68
Allerdings solche Studie sagt uns nicht, was in den Menschen beim Essen oder Trinken von Soja–Lebensmitteln passiert. Kalzium von Sojamilch ist weniger verfügbar (75%) im Vergleich zu Kuhmilch. Jedoch Tofu ist eine mehr konzentrierte Nahrung und die Absorptionsfähigkeit von Kalzium ist sehr gut.
Mit Hilfe eines Crossover–Design, zwei Studien untersuchten die Kalziumaufnahme aus Kalziumsatz–Tofu im Vergleich zu Milch in gesunden, prämenopausalen Frauen. In der ersten Studie wurde Kalziumaufnahme aus Tofu–Satz mit Kalziumkarbonat in kaukasischen Frauen durch fäkale Wiederherstellung des stabilen Isotopen, 44Ca bestimmt. In der zweiten Studie wurde die Kalziumabsorption in asiatischen Frauen aus Tofu–Satz mit Kalziumsulfat durch Auftreten von 45Ca im Blut nach 5 Stunden bestimmt. Die Analyse der sowohl getrennten und kombinierten Untersuchungen zeigte, dass Kalziumaufnahme ähnlich zwischen Kalziumsatz–Tofu und Milch war.69 Mit anderen Worten, Kalzium wurde genauso gut aus dem Tofu absorbiert, wie es aus Kuhmilch war.
Tofu reduziert Bleivergiftung
Tofu hat sich gezeigt, Bleiwerte in der chinesischen Männer und Frauen zu verringern, die Blei–ausgesetzt wurden. Je höher die Einnahme von Tofu ist, desto geringer ist der Blei–Blutspiegel. In einer prospektiven Kohortenstudie im Bereich der reproduktiven Gesundheit wurden 605 Männer und 550 Frauen untersucht, die Grundlinie–Fragebögen ausgefüllt haben und die Blutblei–Messungen im Zeitraum 1996–1998 hatten. Die mittleren Blutbleiwerte waren 13.2 µg/dl bei Männern und 10.1 µg/dl bei Frauen. Blutbleiwerte waren negativ mit Tofu Aufnahme bei beiden Geschlechtern verbunden. Ein linearer Trendtest zeigte eine 3.7% (0,5 µg/dl) Abnahme des Blutbleispiegels mit jeder höherer Kategorie von Tofu Aufnahme (p=0.003). Die höchste Tofu–Aufnahme Gruppe (≥ 750 g/Woche) hatte Blutbleiwerte 11.3% niedriger (95% Konfidenzintervall: 4.1, 18.0) als diejenigen mit der niedrigsten Tofu–Aufnahme.70
Zusammengenommen deuten diese Studien, dass in einer ausgewogenen Ernährung der verschiedenen Soja–Lebensmittel, Absorptionsfähigkeit von Kalzium und anderen Mineralien deutlich reduziert ist und das Ersetzen von Soja–Lebensmittel wie Sojamilch, Tofu und Tempeh für Milchprodukte nicht zu Mineralstoffmangel zu erzeugen ist.
Trypsininhibitoren
Weitere in Soja entdeckte Verbindungen, die häufig als Problem genannt werden, sind darin enthaltene Trypsininhibitoren. Im aktiven Zustand hemmen diese Proteine Trypsin, ein Verdauungsenzym von der Bauchspeicheldrüse, das uns Proteinverdauung ermöglicht. Glücklicherweise sind Trypsininhibitoren fast vollständig durch das typische Kochen von Sojabohnen deaktiviert. Es gibt keinen wissenschaftlichen Beweis, dass der kleine Prozentsatz der verbleibenden Inhibitoren irgendwelche nachteiligen Auswirkungen auf die menschliche Gesundheit, die Verdaulichkeit oder Aminosäure–Absorption hat. Zusätzlich Trypsininhibitoren haben Anti–Krebs–Eigenschaften.71
Referenzen
- Kobayashi S. Trends in national nutritional survey of Japan. Nutr.Health. 1992;8(2-3):91-96.
- Lee MM, Gomez SL, Chang JS, Wey M, Wang RT, Hsing AW. Soy and isoflavone consumption in relation to prostate cancer risk in China. Cancer Epidemiol.Biomarkers Prev. 2003;12(7):665-668.
- Maskarinec G, Verheus M, Steinberg FM, et al. Various doses of soy isoflavones do not modify mammographic density in postmenopausal women. The Journal of nutrition. 2009;139(5):981-986.
- Cui X, Dai Q, Tseng M, Shu XO, Gao YT, Zheng W. Dietary patterns and breast cancer risk in the shanghai breast cancer study. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. 2007;16(7):1443-1448.
- Hamilton-Reeves JM, Vazquez G, Duval SJ, Phipps WR, Kurzer MS, Messina MJ. Clinical studies show no effects of soy protein or isoflavones on reproductive hormones in men: results of a meta-analysis. Fertility and sterility. 2010;94(3):997-1007.
- Fruzza AG, Demeterco-Berggren C, Jones KL. Unawareness of the effects of soy intake on the management of congenital hypothyroidism. Pediatrics. 2012;130(3):e699-702.
- Teas J, Hurley TG, Hebert JR, Franke AA, Sepkovic DW, Kurzer MS. Dietary seaweed modifies estrogen and phytoestrogen metabolism in healthy postmenopausal women. The Journal of nutrition. 2009;139(5):939-944.
- Dillingham BL, McVeigh BL, Lampe JW, Duncan AM. Soy protein isolates of varied isoflavone content do not influence serum thyroid hormones in healthy young men. Thyroid : official journal of the American Thyroid Association. 2007;17(2):131-137.
- Khaodhiar L, Ricciotti HA, Li L, et al. Daidzein-rich isoflavone aglycones are potentially effective in reducing hot flashes in menopausal women. Menopause. 2008;15(1):125-132.
- Romualdi D, Costantini B, Campagna G, Lanzone A, Guido M. Is there a role for soy isoflavones in the therapeutic approach to polycystic ovary syndrome? Results from a pilot study. Fertil.Steril. 2008;90(5):1826-1833.
- Marini H, Bitto A, Altavilla D, et al. Breast safety and efficacy of genistein aglycone for postmenopausal bone loss: a follow-up study. The Journal of clinical endocrinology and metabolism. 2008;93(12):4787-4796.
- Messina M, Redmond G. Effects of soy protein and soybean isoflavones on thyroid function in healthy adults and hypothyroid patients: a review of the relevant literature. Thyroid : official journal of the American Thyroid Association. 2006;16(3):249-258.
- Watanabe S, Terashima K, Sato Y, Arai S, Eboshida A. Effects of isoflavone supplement on healthy women. BioFactors. 2000;12(1-4):233-241.
- Teas J, Braverman LE, Kurzer MS, Pino S, Hurley TG, Hebert JR. Seaweed and soy: companion foods in Asian cuisine and their effects on thyroid function in American women. J.Med Food. 2007;10(1):90-100.
- Cheng G, Wilczek B, Warner M, Gustafsson JA, Landgren BM. Isoflavone treatment for acute menopausal symptoms. Menopause. 2007;14(3 Pt 1):468-473.
- Knight DC, Howes JB, Eden JA, Howes LG. Effects on menopausal symptoms and acceptability of isoflavone-containing soy powder dietary supplementation. Climacteric : the journal of the International Menopause Society. 2001;4(1):13-18.
- Imhof M. Soy isoflavones improve menopausal symptoms: A clinical study report. 8th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Nov. 9-12. Tokyo American Oil Chemists Society; 2008.
- Imhof M, Gocan A, Imhof M, Schmidt M. Improvement of menopausal symptoms by soy isoflavones: A randomized, double-blind study. Planta Med. 2008;74 (9):928.
- Chung CW, Hyun TS, Han HS, Kim KY. Clinical evaluation of ready-to-feed soy based formula. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Andres A, Cleves MA, Bellando JB, Pivik RT, Casey PH, Badger TM. Developmental status of 1-year-old infants fed breast milk, cow’s milk formula, or soy formula. Pediatrics. 2012;129(6):1134-1140.
- Kurosu M. Biologically Active Molecules from Soybeans, Soybean and Health, (Ed.), ISBN: 978-953-307-535-8, InTech, DOI: 10.5772/18950. Available from: http://www.intechopen.com/books/soybean-and-health/biologically-active-molecules-from-soybeans. 2011.
- Sehmisch S, Hammer F, Christoffel J, et al. Comparison of the phytohormones genistein, resveratrol and 8-prenylnaringenin as agents for preventing osteoporosis. Planta Med. 2008;74(8):794-801.
- Wuttke W, Jarry H, Seidlova-Wuttke D. Isoflavones–safe food additives or dangerous drugs? Ageing research reviews. 2007;6(2):150-188.
- Andrade JE, Ju YH, Baker C, Doerge DR, Helferich WG. Long-term exposure to dietary sources of genistein induces estrogen-independence in the human breast cancer (MCF-7) xenograft model. Molecular nutrition & food research. 2014.
- Allred CD, Allred KF, Ju YH, Virant SM, Helferich WG. Soy diets containing varying amounts of genistein stimulate growth of estrogen-dependent (MCF-7) tumors in a dose-dependent manner. Cancer Res. 2001;61(13):5045-5050.
- Allred CD, Allred KF, Ju YH, et al. Dietary genistein results in larger MNU-induced, estrogen-dependent mammary tumors following ovariectomy of Sprague-Dawley rats. Carcinogenesis. 2004;25(2):211-218.
- Helferich WG, Andrade JE, Hoagland MS. Phytoestrogens and breast cancer: a complex story. Inflammopharmacology. 2008;16(5):219-226.
- de Lemos ML. Effects of soy phytoestrogens genistein and daidzein on breast cancer growth. The Annals of pharmacotherapy. 2001;35(9):1118-1121.
- Bodinet C, Freudenstein J. Influence of marketed herbal menopause preparations on MCF-7 cell proliferation. Menopause. 2004;11(3):281-289.
- Hsieh CY, Santell RC, Haslam SZ, Helferich WG. Estrogenic effects of genistein on the growth of estrogen receptor-positive human breast cancer (MCF-7) cells in vitro and in vivo. Cancer Res. 1998;58(17):3833-3838.
- Anonymous. USDA Database for the Isoflavone Content of Selected Foods. Release 2.0. Beltsville, MD: Agricultural Research Service, US Department of Agriculture; 2008.
- Setchell KD. Assessing risks and benefits of genistein and soy. Environ.Health Perspect. 2006;114(6):A332-A333.
- Setchell KD, Brown NM, Zhao X, et al. Soy isoflavone phase II metabolism differs between rodents and humans: implications for the effect on breast cancer risk. The American journal of clinical nutrition. 2011;94(5):1284-1294.
- Branca F, Lorenzetti S. Health effects of phytoestrogens. Forum of nutrition. 2005;57:100-111.
- Bennets HW, Underwood EJ, Shier FLA. A specific breeding problem of sheep on subterranean clover pastures in Western Australia. Aust.Vet.J. 1946;22 2-12.
- Kuiper GG, Enmark E, Pelto-Huikko M, Nilsson S, Gustafsson JA. Cloning of a novel receptor expressed in rat prostate and ovary. Proc Natl.Acad.Sci.U.S A. 1996;93(12):5925-5930.
- Harris DM, Besselink E, Henning SM, Go VL, Heber D. Phytoestrogens induce differential estrogen receptor alpha- or Beta-mediated responses in transfected breast cancer cells. Experimental biology and medicine. 2005;230(8):558-568.
- McCarty MF. Isoflavones made simple – genistein’s agonist activity for the beta-type estrogen receptor mediates their health benefits. Medical hypotheses. 2006;66(6):1093-1114.
- Joshi JV, Vaidya RA, Pandey SN, et al. Plasma levels of genistein following a single dose of soy extract capsule in Indian women. The Indian journal of medical research. 2007;125(4):534-541.
- Choi SY, Ha TY, Ahn JY, et al. Estrogenic activities of isoflavones and flavones and their structure-activity relationships. Planta Med. 2008;74(1):25-32.
- Messina M, Wu AH. Perspectives on the soy-breast cancer relation. The American journal of clinical nutrition. 2009;89(5):1673S-1679S.
- Gruber CJ, Tschugguel W, Schneeberger C, Huber JC. Production and actions of estrogens. The New England journal of medicine. 2002;346(5):340-352.
- Nagata C, Oba S, Shimizu H. Associations of menstrual cycle length with intake of soy, fat, and dietary fiber in Japanese women. Nutrition and cancer. 2006;54(2):166-170.
- Wu AH, Yu MC, Tseng CC, Pike MC. Epidemiology of soy exposures and breast cancer risk. British journal of cancer. 2008;98(1):9-14.
- Wu AH, Koh WP, Wang R, Lee HP, Yu MC. Soy intake and breast cancer risk in Singapore Chinese Health Study. British journal of cancer. 2008;99(1):196-200.
- Kurzer MS. Soy consumption for reduction of menopausal symptoms. Inflammopharmacology. 2008;16(5):227-229.
- Guha N, Kwan ML, Quesenberry CP, Jr., Weltzien EK, Castillo AL, Caan BJ. Soy isoflavones and risk of cancer recurrence in a cohort of breast cancer survivors: the Life After Cancer Epidemiology study. Breast cancer research and treatment. 2009;118(2):395-405.
- Wu AH, Yu MC, Tseng CC, Stanczyk FZ, Pike MC. Dietary patterns and breast cancer risk in Asian American women. The American journal of clinical nutrition. 2009;89(4):1145-1154.
- Messina M. Resolving the soy-breast cancer controversy. Journal of the American Dietetic Association. 2006;106(3):363-364.
- Kuiper GG, Carlsson B, Grandien K, et al. Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta. Endocrinology. 1997;138(3):863-870.
- Strom BL, Schinnar R, Ziegler EE, et al. Exposure to soy-based formula in infancy and endocrinological and reproductive outcomes in young adulthood. JAMA. 2001;286(7):807-814.
- Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake increases bone mineral density in the spine of menopausal women: meta-analysis of randomized controlled trials. Clinical nutrition. 2008;27(1):57-64.
- Shu XO. Soy food intake among breast cancer patients: Association with survival and menopausal symptoms. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Nasr E, Nasr D, Azoury F, Fares G. Outcome and prognostic factors in the conservative treatment of breast cancer. J.Med Liban. 2009;57(2):130-134.
- Dorjgochoo T, Gu K, Kallianpur A, et al. Menopausal symptoms among breast cancer patients 6 months after diagnosis: a report from the Shanghai Breast Cancer Survival Study. Menopause. 2009;16(6):1205-1212.
- Lundström E. Effects of isoflavones on in vivo breast cell proliferation in normal subjects and breast cancer patients. Symposium on Evaluating the Efficacy and Safety of Isoflavones for Postmenopausal Women, 13-14 May. Milan (Italy): Council for Responsible Nutrition 2009.
- Messina M. Effects of isoflavones on endometrial tissue and endometrial cancer risk. Symposium on Evaluating the Efficacy and Safety of Isoflavones for Postmenopausal Women, 13-14 May. Milan (Italy): Council for Responsible Nutrition 2009.
- Tice JA. Effects of isoflavones on mammographic breast density in pre- and postmenopausal women. Symposium on Evaluating the Efficacy and Safety of Isoflavones for Postmenopausal Women, 13-14 May. Milan (Italy): Council for Responsible Nutrition 2009.
- Shu XO. Soyfood consumption and breast cancer prognosis: Review of the epidemiologic data. Symposium on Evaluating the Efficacy and Safety of Isoflavones for Postmenopausal Women, 13-14 May. Milan (Italy): Council for Responsible Nutrition 2009.
- Boyapati SM, Shu XO, Ruan ZX, et al. Soyfood intake and breast cancer survival: a followup of the Shanghai Breast Cancer Study. Breast cancer research and treatment. 2005;92(1):11-17.
- Shu XO, Zheng Y, Cai H, et al. Soy food intake and breast cancer survival. JAMA. 2009;302(22):2437-2443.
- Fink BN, Steck SE, Wolff MS, et al. Dietary Flavonoid Intake and Breast Cancer Survival among Women on Long Island. Cancer Epidemiol.Biomarkers Prev. 2007;16(11):2285-2292.
- Kang X, Zhang Q, Wang S, Huang X, Jin S. Association between soy isoflavone intake and breast cancer recurrence and survival among postoperative patients receiving adjuvant endocrine therapy. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Kang X, Zhang Q, Wang S, Huang X, Jin S. Effect of soy isoflavones on breast cancer recurrence and death for patients receiving adjuvant endocrine therapy. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 2010;182(17):1857-1862.
- EFSA. EFSA supporting publication 2013:EN-506 EXTERNAL SCIENTIFIC REPORT Literature searches and reviews related to the prevalence of food allergy in Europe CFT/EFSA/NUTRI/2012/021 University of Portsmouth. 2013. http://www.efsa.europa.eu/en/search/doc/506e.pdf.
- Lee AJ, Thalayasingam M, Lee BW. Food allergy in Asia: how does it compare? Asia Pac Allergy. 2013;3(1):3-14.
- Sutardi A, Buckle KA. Reduction in Phytic Acid Levels in Soybeans
 Auswirkungen auf die Östrogen–Rezeptoren und Anti–Krebs–Wirkung
Auswirkungen auf die Östrogen–Rezeptoren und Anti–Krebs–Wirkung
Die östrogene oder anti–östrogene Aktivität eines Phytoöstrogen kann je nach den Versuchsbedingungen der in vitro und in vivo Studien und nach dem Design der klinischen und epidemiologischen Studien variieren. Außerdem sind Agonisten– oder Antagonisten–Effekte vom Östrogenstatus im Gewebe und Blut und von der Verteilung der Subtypen von Östrogen–Rezeptoren in den Organen abhängig. Beispielsweise einige in vitro–Studien an Genistein beurteilen dieses Phytoöstrogen als stark östrogen, wenn die klinische Beobachtung deutet auf eine selektive Östrogen–modulatorische Wirkung hin, die je nach den Bedingungen auch als Anti–östrogene Wirkung interpretiert werden kann. In vitro Genistein kann die Proliferation von östrogenabhängigen MCF–7–Brustkrebszellen in der Abwesenheit von Östrogen erhöhen, wohingegen in Gegenwart bereits die geringen Mengen von Östrogen Genistein die Aktivierung ruhender Brustkrebs Aufrufe inhibiert haben.1 Klinisch, eine hohe Zufuhr von Genistein, z.B. von Soja–Lebensmitteln, wird mit einer geringen Inzidenz von Brustkrebs korreliert.2
Isoflavonen sollten nicht mehr als „Phytoöstrogene“ betrachtet werden, da sie nicht wie ein simples Östrogenagonist wirken. Heute werden sie als „Selektive Östrogenreceptor–Modulators“ (SÖRMs) angesehen, was besser die komplexe Interaktion auf der alpha und – ganz wichtig – beta Östrogen–Rezeptoren Ebene widerspiegelt.
Studien setzen fort, die antiproliferative Wirkung von Soja–Isoflavonen zu bestätigen:
–Genistein wurde gezeigt, hormonsensitivem Krebszellproliferation durch die Mechanismen, die die Festnahme des Zellzyklus umfassenm4,5 zu hemmen.3
–Genistein kehrt krebsfördernde östrogene Wirkung von Bisphenol A durch die Induktion der Apoptose um.6
–Genistein hemmt Krebszellproliferation durch Inhibierung von Topoisomerase II.7
–Genistein und Daidzein herunterregulieren Gene–steigernde Krebszellproliferation.8
Qualität der in vivo Studien zeigt konsequent, dass eine Soja– und Isoflavonen–reiche Ernährung eine schützende Wirkung gegen die Entwicklung von Krebs hat.9–17 Die zitierten Literaturstellen sind keineswegs erschöpfend. Die Untersuchungen zur Tumorprävention zeigten eine schützende Wirkung von Soja–Isoflavonen gegen verschiedene Krebsarten. Ein erhöhtes Risiko kann aus den schlecht konzipierten oder ungeeigneten Tiermodellen extrapoliert werden.
Die antidiabetischen Effekte
Genistein hat sich gezeigt, diabetische in vivo Wundheilung zu verbessern. Sie hat die verzögerte Wundheilung gerettet und die Wund–Angiogenese in chemisch–induzierten Diabetes Typ 1 in Mäusen verbessert.18
Herz–Kreislauf–Effekte
Untersuchungen kommen zufolge, dass Soja–Isoflavone die antiatherogenen Effekte durch eine Verringerung der Expression von Adhäsionsmolekülen haben und sowohl als Schutzmittel als auch als therapeutische Mittel wirken.19
Genistein in den Konzentrationen, die durch die Aufnahme von Phytoöstrogen–reichen Soja verfügbar sind, ist gezeigt worden, die Dilatation ex vivo von kleinen peripheren Arterien von normalen Männern und derjenigen mit etablierter koronarer Herzkrankheit zu verursachen. Der Beitrag vom Stickstoffmonoxid zu den auf diese Verbindungen verspäteten Antworten ist relevant für Arterien von Kontroll Männchen, während andere Stickstoffoxid unabhängige dilatorischen Mechanismen sind in den Arterien durch koronare Herzkrankheit beteiligt.20 Genistein hat ferner gezeigt, die zytoprotektive antioxidative Gene zu aktivieren, die eine neuartige Strategie zur Vorbeugung und Behandlung von kardiovaskulären Endothelschädigung darstellen zu können.21
Auswirkung auf Knochen
Die Wirkung von Soja–Isoflavonen auf den Knochenstoffwechsel ist vielfältig. Einige Studien fanden, dass Soja den Knochenverlust nach chirurgisch induzierter „Menopause“ bei Ratten durch die Erhöhung der Knochenbildung oder durch eine Knochen–schonende Wirkung verhindert hat.22–25 Allerdings nicht alle Studien haben positive Effekte gezeigt. Eine Studie ergab, dass Genistein als einmal täglich oral einzunehmendes Nahrungsergänzungsmittel keinen positiven Effekt auf das Schienbein in Rattenmodellen für den postmenopausalen Knochenverlust26 hatte, während eine andere Studie ergab, dass Equol, jedoch keine Genistein, frühe metaphysäre Frakturheilung in osteoporotischen Ratten verbessert hat.27
Auswirkungen auf die Schilddrüsenfunktion
Sojaprodukte scheinen Schilddrüsenfunktion in einer inkonsistenten Art und Weise zu beeinträchtigen, da die Studien haben sowohl Erhöhungen als auch Abnahmen den gleichen Parametern der Schilddrüsenaktivität gezeigt. Einweichen, Fermentation und Wärme können problematische in Soja enthaltene Anti–Nährstoffe reduzieren. Eine kürzlich durchgeführte Studie28 ergab, dass Nahrungssoja die Trijodthyronin in vor–ovarektomierten Affen erhöht und einen Rückgang des Thyroxins nach chirurgischer Menopause verhindert. Die in dieser Studie beobachteten Ergebnisse schlagen vor, dass Sojaprotein– und Isoflavone– Verbrauch keine negativen Auswirkungen hat, und dass es sogar zur Bewahrung der Schilddrüsenfunktion bei postmenopausalen Frauen führen kann.28
Neuroprotektive Wirkung
Vorbehandlung mit Genistein ergab eine Verbesserung der Überlebensrate der menschlichen Neuroblastom SK–N–SH–Zellen gegen 6–Hydroxydopamin–induzierte Neurotoxizität. Die Aktivierung des IGF–I–Rezeptor Signalwegs könnte Genistein einbeziehen.29
Nierenschutzaktivitäten
Aufeinanderfolgende Behandlung von Sojaproteinisolat wurde gezeigt, gegen eine Nierenfunktionsstörung, insbesondere tubulointerstitielle Nephritis, in Desoxycorticosteronacetat behandelten übergewichtigen Zucker Ratten zu schützen.30
Aromatasehemmung
Aromatase ist das für die Umwandlung von Androstendion in Östron in Fettzellen verantwortliche Enzym. Lignanen und Isoflavonen wurden gezeigt, die Aromatase in vitro zu hemmen.31 Der Grad der Hemmung kann variieren, je nachdem, welche der Pflanzenöstrogene getestet werden. Hypothetisch könnte dies zu einer Verringerung der Produktion und Verfügbarkeit von endogenem Östrogen führen. Allerdings die erforderlichen Mengen von Isoflavonen sind für eine nennenswerte Hemmung mit Isoflavone–Nahrung unwahrscheinlich erreicht zu werden.
5–α–Reduktase–Hemmung
Isoflavone und Lignane reduzieren die Umwandlung von Testosteron zu Dihydrotestosteron (DHT) durch die Hemmung der 5α–Reduktase–Enzym Aktivität. Dies könnte vorteilhaft für Frauen mit Androgenüberschuss bezogenen Bedingungen und möglicherweise für Männern mit Prostata–Hyperplasie sein – ein weiterer Hinweis, wo die vorteilhafte Wirkungen von Isoflavonen gezeigt wurden.32–34 Jedoch die erforderlichen Konzentrationen von Serum–Phytoöstrogene für eine relevante Hemmung von 5α–Reduktase können möglicherweise nicht mit Nahrungsquellen erreicht werden.
Hemmung der 17β–Hydroxysteroiddehydrogenase
Phytoöstrogen kann 17β–Hydroxysteroiddehydrogenase I (17β–HSOR I) zu hemmen, das für die metabolische Umwandlung von Östron zu Östradiol verantwortliche Enzym. Hemmung der 17β–HSOR I ist mit einer anti–östrogenen Wirkung verwandt. Estrone wird als mehr krebserzeugende zu östrogenabhängigen Geweben als Estradiol angenommen und es kann das Krebswachstum reduzieren.35
Antioxidanseffekt
Isoflavone wurden gezeigt starke antioxidative Wirkung zu besitzen.36–38 Es ist zu erwarten andere Anti–Krebswirkungen der Phytoöstrogene zu potenzieren.
Auswirkungen auf die Adipogenese
Ernährungsbedingte Aufnahme von Sojaprodukten ist mit niedrigerem Brusttumor–Risiko und reduziertem Körpergewicht, Fettleibigkeit und Entzündungen in Nagetier–Brustkrebs–Modellen zugeordnet. Die Ergebnisse einer Studie legen nahe, einen mechanistischen Weg zur direkten Regulierung der Milchfettsucht durch Genistein für Brustkrebs–Prävention zu unterstützen.39,40 Soja ist auch gezeigt worden, hepatoprotektive und positive Auswirkungen auf den Stoffwechsel in einer Studie von nichtalkoholischer Steatohepatitis in fettleibigen Zucker Ratten zu haben.41
Anti–Krebs–Aktivitäten
Viele der von Phytoöstrogenen bereitgestellten gesundheitlichen Vorteile beruhen auf die Mechanismen, die anders als deren Interaktion mit Östrogen–Rezeptoren sind – zum Beispiel, deren Einfluss auf die Zellproliferation, die Proteinsynthese, die Angiogenese und die Lipidoxidation.42,43 Kochen oder Verarbeitung von Sojabohnen scheint nur die Anti–Krebs–Eigenschaften zu verbessern.44
Hemmung der Angiogenese
Eine sehr komplexe Kaskade der Rezeptoren, Enzyme und Mediatoren ist in der Signalkaskade der Angiogenese beteiligt. Jeder Schritt in der Kette von Ereignissen, die zu Angiogenese führen, ist ein mögliches therapeutisches Ziel gegen Tumorwachstum. Die Signalkaskade ist komplex und beinhaltet Vielzahl von Faktoren, die von sich selbst Enzyme oder Gene aktivieren, die zur Bildung von bestimmten Rezeptoren führen oder die die Wanderung von Zellen erleichtern (Metastasen sowie Endothelzellen für die Mikrogefßzellen–Bildung). Isoflavone wirken auf verschiedenen Ebenen der Neoangiogenese–Signalkaskade, wie in vitro und in Tierexperimenten nachgewiesen.45 In Tierversuchen hemmen die Sojaprodukte die Entwicklung von Krebs, was durch eine verringerte Bildung von Mikrokapillaren im Tumor exprimiert wird.46
Hemmung der Krebsproliferation
Isoflavone sind gezeigt worden, die Proliferation zu reduzieren4,7,8,47–49 und das Promotor IGF–1 Wachstum50 und Krebspfade51zu hemmen.
Induktion der Apoptose in Krebszellen
Pathologische Prozesse führen zu der Aktivierung von Apoptose oder zum programmierten Zelltod. Dieser Mechanismus funktioniert nicht in Krebszellen. Das Programm der Apoptose wird unterbrochen und die Zellen werden potentiell unsterblich. Ein der Ziele der Tumorbehandlung ist daher die erneute Aktivierung der Apoptose auf das normale Niveau. Genistein fördert Apoptose, was zu einer Verringerung des Tumorvolumens und reduzierten Angiogenese führt (Entwicklung neuer Krebsblutgefäße, um den Tumor zu unterstützen). Positive Auswirkungen auf die Wiederherstellung eines normalen Muster der Apoptose wurden unter anderem mit Brustkrebszellen52, Leukämiezellen53 und Prostata–Zellen54 nachgewiesen.
Wirkungen auf die Matrixmetalloproteinasen, Tyrosin Kinase und NF–kB
Das Tumorwachstum ist kein isoliertes Ereignis, sondern geschieht in Gewebe, die bereits vom gesunden Gewebe eingenommen ist. Diese gesunden Gewebe sind in einer extrazellulären Matrix verankert. Um ein Platz für eine Invasion von Metastasen und/oder für das Tumorwachstum zu erstellen, muss diese extrazelluläre Matrix zuerst abgebaut werden. Der Abbau erfordert Proteasen. Demzufolge die Matrixmetalloproteinasen (MMPs) sind ein wichtiges therapeutisches Zielmolekül für die Tumor Prävention und Behandlung. Die Wirkung von MMPs auf die extrazelluläre Matrix ermöglicht das Zellwachstum, die Zellteilung, die Migration wie auch die Invasion von Krebszellen und von Angiogenese.55 Die Aktivität der MMPs wird durch Enzyme, wie z.B. Proteinkinase oder Tyrosinkinase, und den Mastergen–Schalter für Entzündungen – NF–kB moduliert. In Tumoren sind erhöhte Mengen von MMPs befreit. Beispielsweise in Mäusen mit Brustkrebs MMP–9 wird erhöht.56 Genistein hemmt die Tyrosinkinase, NF–kB56 und TGF–b1, eine andere Verbindung für Tumorinvasion notwendig.57
Chemopräventive Effekte
Soja–Isoflavone sind gezeigt worden, die Entwicklung von chemisch induzierten Brusttumoren signifikant zu hemmen.58–60
Strahlenschutz
Strahlentherapie vom lokal fortgeschrittenen nicht–kleinzelligen Lungenkarzinom wird durch Strahlen–induzierte Pneumonitis und Fibrose beschränkt. In vitro und in vivo Studien haben eine differentielle Wirkung von Soja–Isoflavonen auf verstärkende Tumorzerstörung durch Strahlung induzierte Tumorzerstörung, während des gleichzeitigen Schutzes der normalen Lungengewebe nachgewiesen. Die Ergebnisse der Untersuchungen zeigen, dass die Soja–Isoflavone gegebene Pre– und Post– Strahlung, die Lungen vor den nachteiligen Auswirkungen der Strahlung, einschließlich Hautverletzung, Haarausfall, erhöhte Atemfrequenz, Entzündungen, Lungenentzündung und Fibrose geschützt hat, bereitstellt den Beweis für eine strahlenschützende Wirkung von Soja.61
Epigenetische Veränderung
Epigenetische Modifikationen sind über eine Reihe von Mechanismen vermittelt. Die am meisten untersuchte sind Methylierung und Acetylierung von Histonen, die die Expression von Genen beeinflussen. Soja–Isoflavone haben gezeigt, Antikrebs epigenetischen, mit Hochregulierung von Antikrebs–Genen assoziierten Veränderungen (Tumorsuppressorgene) und Herunterregulierung von pro–Krebs–Gene (Onkogene) zu induzieren.62–65
Antimetastatische Effekte
Krebsmetastasierung bezieht sich auf die Ausbreitung von Krebszellen von der primären Neubildung auf Fernstellen, wo Sekundärtumoren gebildet werden, und ist die Hauptursache für Tod durch Krebs. Natürlichen sekundären Pflanzenstoffen, die die phenolische Verbindungen enthalten, wurden weitgehend gezeigt, die Fähigkeit zur Metastasierung Verhinderung zu haben. Unter phenolischen Verbindungen sind Flavonoide eine sehr große Unterklasse, die reich in Nahrungsmitteln und Nutrazeutika ist. Die Zahl der Berichte, die zeigen, dass Flavonoide ein wirksames natürliches Inhibitor von Krebsinvasion und Metastasierung ist, steigt in der wissenschaftlichen Literatur. Catechin–abgeleitete Verbindungen, Genistein, Silibinin, Quercetin, und Anthocyanin wurden weitgehend für ihre hemmende Wirkung auf Invasion / Metastasen untersucht.66
Hemmung des Prostatakarzinoms
Soja und ihr Bestandteil Isoflavon: Genistein hemmen die Entwicklung und das Fortschreiten des Prostatakarzinoms durch eine Vielzahl von Mechanismen.67
Referenzen
- Imhof M, Molzer S, Imhof M. Effects of soy isoflavones on 17beta-estradiol-induced proliferation of MCF-7 breast cancer cells. Toxicology in vitro : an international journal published in association with BIBRA. 2008;22(6):1452-1460.
- Messina M, Wu AH. Perspectives on the soy-breast cancer relation. The American journal of clinical nutrition. 2009;89(5):1673S-1679S.
- Choi EJ, Kim GH. Antiproliferative activity of daidzein and genistein may be related to ER(alpha)/c-erbB-2 expression in human breast cancer cells. Molecular Medicine Reports. 2013;7(3):781-784.
- Hwang KA, Kang NH, Yi BR, Lee HR, Park MA, Choi KC. Genistein, a soy phytoestrogen, prevents the growth of BG-1 ovarian cancer cells induced by 17(beta)-estradiol or bisphenol A via the inhibition of cell cycle progression. International journal of oncology. 2013;42(2):733-740.
- Tsuboy MS, Marcarini JC, de Souza AO, et al. Genistein at Maximal Physiologic Serum Levels Induces G0/G1 Arrest in MCF-7 and HB4a Cells, But Not Apoptosis. Journal of medicinal food. 2014;17(2):218-225.
- Hwang KA, Park MA, Kang NH, et al. Anticancer effect of genistein on BG-1 ovarian cancer growth induced by 17 beta-estradiol or bisphenol A via the suppression of the crosstalk between estrogen receptor alpha and insulin-like growth factor-1 receptor signaling pathways. Toxicology and applied pharmacology. 2013;272(3):637-646.
- Mizushina Y, Shiomi K, Kuriyama I, Takahashi Y, Yoshida H. Inhibitory effects of a major soy isoflavone, genistein, on human DNA topoisomerase II activity and cancer cell proliferation. International journal of oncology. 2013;43(4):1117-1124.
- Lepri SR, Zanelatto LC, da Silva PB, Sartori D, Ribeiro LR, Mantovani MS. The effects of genistein and daidzein on cell proliferation kinetics in HT29 colon cancer cells: the expression of CTNNBIP1 (beta-catenin), APC (adenomatous polyposis coli) and BIRC5 (survivin). Human cell. 2014.
- Lamartiniere CA, Cotroneo MS, Fritz WA, Wang J, Mentor-Marcel R, Elgavish A. Genistein chemoprevention: timing and mechanisms of action in murine mammary and prostate. The Journal of nutrition. 2002;132(3):552S-558S.
- Zaizen Y, Higuchi Y, Matsuo N, Shirabe K, Tokuda H, Takeshita M. Antitumor effects of soybean hypocotyls and soybeans on the mammary tumor induction by N-methyl-n-nitrosourea in F344 rats. Anticancer research. 2000;20(3A):1439-1444.
- Constantinou AI, Mehta RG, Vaughan A. Inhibition of N-methyl-N-nitrosourea-induced mammary tumors in rats by the soybean isoflavones. Anticancer Res. 1996;16(6A):3293-3298.
- Constantinou AI, Lantvit D, Hawthorne M, Xu X, van Breemen RB, Pezzuto JM. Chemopreventive effects of soy protein and purified soy isoflavones on DMBA-induced mammary tumors in female Sprague-Dawley rats. Nutrition and cancer. 2001;41(1-2):75-81.
- Hakkak R, Korourian S, Shelnutt SR, Lensing S, Ronis MJ, Badger TM. Diets containing whey proteins or soy protein isolate protect against 7,12-dimethylbenz(a)anthracene-induced mammary tumors in female rats. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. 2000;9(1):113-117.
- Hawrylewicz EJ, Huang HH, Blair WH. Dietary soybean isolate and methionine supplementation affect mammary tumor progression in rats. J.Nutr. 1991;121(10):1693-1698.
- Lamartiniere CA, Moore JB, Brown NM, Thompson R, Hardin MJ, Barnes S. Genistein suppresses mammary cancer in rats. Carcinogenesis. 1995;16(11):2833-2840.
- Lamartiniere CA, Moore J, Holland M, Barnes S. Neonatal genistein chemoprevents mammary cancer. Proc Soc.Exp.Biol.Med. 1995;208(1):120-123.
- Gotoh T, Yamada K, Ito A, Yin H, Kataoka T, Dohi K. Chemoprevention of N-nitroso-N-methylurea-induced rat mammary cancer by miso and tamoxifen, alone and in combination. Jpn J.Cancer Res. 1998;89(5):487-495.
- Tie L, An Y, Han J, et al. Genistein accelerates refractory wound healing by suppressing superoxide and FoxO1/iNOS pathway in type 1 diabetes. Journal of Nutritional Biochemistry. 2013;24(1):88-96.
- De Andrade CM, De Sa MFS, Toloi MRT. Effects of phytoestrogens derived from soy bean on expression of adhesion molecules on HUVEC. Climacteric : the journal of the International Menopause Society. 2012;15(2):186-194.
- Cruz MN, Luksha L, Logman H, Poston L, Agewall S, Kublickiene K. Acute responses to phytoestrogens in small arteries from men with coronary heart disease. American journal of physiology. Heart and circulatory physiology. 2006;290(5):H1969-1975.
- Zhang T, Wang F, Xu HX, et al. Activation of nuclear factor erythroid 2-related factor 2 and PPARgamma plays a role in the genistein-mediated attenuation of oxidative stress-induced endothelial cell injury. The British journal of nutrition. 2013;109(2):223-235.
- Arjmandi BH, Getlinger MJ, Goyal NV, et al. Role of soy protein with normal or reduced isoflavone content in reversing bone loss induced by ovarian hormone deficiency in rats. The American journal of clinical nutrition. 1998;68(6 Suppl):1358S-1363S.
- Arjmandi BH, Birnbaum R, Goyal NV, et al. Bone-sparing effect of soy protein in ovarian hormone-deficient rats is related to its isoflavone content. The American journal of clinical nutrition. 1998;68(6 Suppl):1364S-1368S.
- Park K, Ju WC, Yeo JH, et al. Increased OPG/RANKL ratio in the conditioned medium of soybean-treated osteoblasts suppresses RANKL-induced osteoclast differentiation. International journal of molecular medicine. 2014;33(1):178-184.
- Santos MA, Florencio-Silva R, Medeiros VP, et al. Effects of different doses of soy isoflavones on bone tissue of ovariectomized rats. Climacteric : the journal of the International Menopause Society. 2013.
- Turner RT, Iwaniec UT, Andrade JE, et al. Genistein administered as a once-daily oral supplement had no beneficial effect on the tibia in rat models for postmenopausal bone loss. Menopause. 2013;20(6):677-686.
- Kolios L, Sehmisch S, Daub F, et al. Equol but not genistein improves early metaphyseal fracture healing in osteoporotic rats. Planta Med. 2009;75(5):459-465.
- D’Adamo CR, Sahin A. Soy foods and supplementation: a review of commonly perceived health benefits and risks. Alternative therapies in health and medicine. 2014;20 Suppl 1:39-51.
- Gao QG, Xie JX, Wong MS, Chen WF. IGF-I receptor signaling pathway is involved in the neuroprotective effect of genistein in the neuroblastoma SK-N-SH cells. European Journal of Pharmacology. 2012;677(1-3):39-46.
- Asanoma M, Tachibana N, Hirotsuka M, Kohno M, Watanabe Y. Effects of soy protein isolate feeding on severe kidney damage in DOCA salt-treated obese Zucker rats. Journal of agricultural and food chemistry. 2012;60(21):5367-5372.
- Adlercreutz H, Bannwart C, Wahala K, et al. Inhibition of human aromatase by mammalian lignans and isoflavonoid phytoestrogens. J.Steroid Biochem.Mol.Biol. 1993;44(2):147-153.
- Messina M, Watanabe S, Setchell KD. Report on the 8th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment. The Journal of nutrition. 2009;139(4):796S-802S.
- Travis RC, Allen NE, Appleby PN, Spencer EA, Roddam AW, Key TJ. A prospective study of vegetarianism and isoflavone intake in relation to breast cancer risk in British women. International journal of cancer. Journal international du cancer. 2008;122(3):705-710.
- Yan L, Spitznagel EL. Soy consumption and prostate cancer risk in men: a revisit of a meta-analysis. The American journal of clinical nutrition. 2009;89(4):1155-1163.
- Key T, Appleby P, Barnes I, Reeves G. Endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J.Natl.Cancer Inst. 2002;94(8):606-616.
- Xu B, Chang SK. Isoflavones, Flavan-3-ols, phenolic acids, total phenolic profiles, and antioxidant capacities of soy milk as affected by ultrahigh-temperature and traditional processing methods. Journal of agricultural and food chemistry. 2009;57(11):4706-4717.
- DiSilvestro RA, Goodman J, Dy E, Lavalle G. Soy isoflavone supplementation elevates erythrocyte superoxide dismutase, but not plasma ceruloplasmin in postmenopausal breast cancer survivors. Breast cancer research and treatment. 2005;89(3):251-255.
- Borras C, Gambini J, Gomez-Cabrera MC, et al. Genistein, a soy isoflavone, up-regulates expression of antioxidant genes: involvement of estrogen receptors, ERK1/2, and NFkappaB. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 2006;20(12):2136-2138.
- Badger TM, Ronis MJJ. Consumption of soy protein protects against hepatic fat accumulation: Activation of PPAR LXR and inhibition of SREBP-1C signalling. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Montales MT, Rahal OM, Nakatani H, Matsuda T, Simmen RC. Repression of mammary adipogenesis by genistein limits mammosphere formation of human MCF-7 cells. The Journal of endocrinology. 2013;218(1):135-149.
- Davis J, Cain J, Butteiger D, Banz WJ. Antagonism of adipogenic programming by soy-based diet protects against non-alcoholic steatohepatitis (NASH) in obese Zucker rats. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Tham DM, Gardner CD, Haskell WL. Potential health benefits of dietary phytoestrogens: a review of the clinical, epidemiological, and mechanistic evidence. J.Clin Endocrinol.Metab. 1998;83(7):2223-2235.
- Constantinou AI, Mehta RG, Vaughan A. Inhibition of N-methyl-N-nitrosourea-induced mammary tumors in rats by the soybean isoflavones. Anticancer research. 1996;16(6A):3293-3298.
- Dong X, Xu W, Sikes RA, Wu C. Apoptotic effects of cooked and in vitro digested soy on human prostate cancer cells. Food chemistry. 2012;135(3):1643-1652.
- Fotsis T, Pepper M, Adlercreutz H, Hase T, Montesano R, Schweigerer L. Genistein, a dietary ingested isoflavonoid, inhibits cell proliferation and in vitro angiogenesis. J.Nutr. 1995;125(3 Suppl):790S-797S.
- Guo Y, Wang S, Hoot DR, Clinton SK. Suppression of VEGF-mediated autocrine and paracrine interactions between prostate cancer cells and vascular endothelial cells by soy isoflavones. The Journal of nutritional biochemistry. 2007;18(6):408-417.
- Ström A, Hartman J, Foster JS, Kietz S, Wimalasena J, Gustafsson JA. Estrogen receptor beta inhibits 17beta-estradiol-stimulated proliferation of the breast cancer cell line T47D. Proceedings of the National Academy of Sciences of the United States of America. 2004;101(6):1566-1571.
- Constantinou A, Mehta R, Runyan C, Rao K, Vaughan A, Moon R. Flavonoids as DNA topoisomerase antagonists and poisons: structure-activity relationships. J.Nat.Prod. 1995;58(2):217-225.
- Diel P, Geis RB, Caldarelli A, et al. The differential ability of the phytoestrogen genistein and of estradiol to induce uterine weight and proliferation in the rat is associated with a substance specific modulation of uterine gene expression. Molecular and cellular endocrinology. 2004;221(1-2):21-32.
- Lee J, Ju J, Park S, Hong SJ, Yoon S. Inhibition of IGF-1 signaling by genistein: Modulation of E-cadherin expression and downregulation of (beta)-catenin signaling in hormone refractory PC-3 prostate cancer cells. Nutrition and cancer. 2012;64(1):153-162.
- Khaw AK, Yong JW, Kalthur G, Hande MP. Genistein induces growth arrest and suppresses telomerase activity in brain tumor cells. Genes, chromosomes & cancer. 2012;51(10):961-974.
- Katdare M, Osborne M, Telang NT. Soy isoflavone genistein modulates cell cycle progression and induces apoptosis in HER-2/neu oncogene expressing human breast epithelial cells. International journal of oncology. 2002;21(4):809-815.
- Uckun FM, Evans WE, Forsyth CJ, et al. Biotherapy of B-cell precursor leukemia by targeting genistein to CD19-associated tyrosine kinases. Science. 1995;267(5199):886-891.
- Risbridger GP, Wang H, Frydenberg M, Husband A. The in vivo effect of red clover diet on ventral prostate growth in adult male mice. Reproduction, fertility, and development. 2001;13(4):325-329.
- Farina HG, Pomies M, Alonso DF, Gomez DE. Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer. Oncology reports. 2006;16(4):885-891.
- Owen JL, Torroella-Kouri M, Iragavarapu-Charyulu V. Molecular events involved in the increased expression of matrix metalloproteinase-9 by T lymphocytes of mammary tumor-bearing mice. International journal of molecular medicine. 2008;21(1):125-134.
- Han L, Zhang HW, Zhou WP, Chen GM, Guo KJ. The effects of genistein on transforming growth factor-beta1-induced invasion and metastasis in human pancreatic cancer cell line Panc-1 in vitro. Chinese medical journal. 2012;125(11):2032-2040.
- Gotoh T, Yamada K, Yin H, Ito A, Kataoka T, Dohi K. Chemoprevention of N-nitroso-N-methylurea-induced rat mammary carcinogenesis by soy foods or biochanin A. Japanese journal of cancer research : Gann. 1998;89(2):137-142.
- Brown NM, Lindley SL, Setchell K. Equol enantiomers mimic genistein in impacting mammary gland development but not in breast cancer prevention. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
- Ma D, Zhang Y, Yang T, Xue Y, Wang P. Isoflavone intake inhibits the development of 7,12-dimethylbenz(a)anthracene(DMBA)-induced mammary tumors in normal and ovariectomized rats. Journal of clinical biochemistry and nutrition. 2014;54(1):31-38.
- Hillman GG, Singh-Gupta V, Lonardo F, et al. Radioprotection of lung tissue by soy isoflavones. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer. 2013;8(11):1356-1364.
- Dagdemir A, Durif J, Ngollo M, Bignon YJ, Bernard-Gallon D. Histone lysine trimethylation or acetylation can be modulated by phytoestrogen, estrogen or anti-HDAC in breast cancer cell lines. Epigenomics. 2013;5(1):51-63.
- Zhang Y, Li Q, Chen H. DNA methylation and histone modifications of Wnt genes by genistein during colon cancer development. Carcinogenesis. 2013;34(8):1756-1763.
- Bosviel R, Durif J, Dechelotte P, Bignon YJ, Bernard-Gallon D. Epigenetic modulation of BRCA1 and BRCA2 gene expression by equol in breast cancer cell lines. The British journal of nutrition. 2012;108(7):1187-1193.
- Li H, Xu W, Huang Y, Huang X, Xu L, Lv Z. Genistein demethylates the promoter of CHD5 and inhibits neuroblastoma growth in vivo. International journal of molecular medicine. 2012;30(5):1081-1086.
- Weng CJ, Yen GC. Flavonoids, a ubiquitous dietary phenolic subclass, exert extensive in vitro anti-invasive and in vivo anti-metastatic activities. Cancer metastasis reviews. 2012;31(1-2):323-351.
- Swami S, Krishnan AV, Moreno J, et al. Inhibition of prostaglandin synthesis and actions by genistein in human prostate cancer cells and by soy isoflavones in prostate cancer patients. International journal of cancer. Journal international du cancer. 2009;124(9):2050-2059.
Arzneimittelforschung
Keine Informationen vorhanden.
 Mittel der Wahl bei Hitzewallungen
Mittel der Wahl bei Hitzewallungen
Ein 2016 erschienenes internationales Konsensuspapier der Österreichischen Menopausegesellschaft empfiehlt Soja-Isoflavone als erstes Mittel der Wahl gegen vasomotorische Beschwerden in der Menopause.
Die Empfehlungen im Detail:
• Die Wirksamkeit von Isoflavonen gegen menopausale Hitzewallungen wurde in unabhängigen Meta-Analysen bestätigt und mit dem Evidenzgrad1a klassifiziert.
• Isoflavone reduzieren die Häufigkeit und die Stärke von Hitzewallungen um rund 25% besser als Placebos und erreichen damit 57% der Wirkung von Östrogenersatzpräparaten.
• Die maximale Wirkung tritt bei Isoflavonen erst später ein als bei einer Östrogenbehandlung. Das ist eine wichtige Information für die Patientinnen. Auf der Risikoseite gibt es kaum negative Wirkungen und eine hohe Patienten-Compliance ist zu erwarten.
• Zusätzliche positive Auswirkungen können für die Knochen erwartet werden.
• Eine hohe Zufuhr von Isoflavonen wird mit einem niedrigeren Brustkrebsrisiko assoziiert.
• Langzeitstudien an Brustkrebspatientinnen zeigen Vorteile bei der Aufnahme von Soja, die sich in einer niedrigeren Rezidivrate und keinen unerwünschten Wechselwirkungen bei der Behandlung mit Tamoxifen und Anastrozol niederschlagen. Brustkrebspatientinnen sollte nicht länger von der Einnahme von Isoflavonen abgeraten werden.
• Die Langzeitsicherheit für hormonabhängiges Gewebe wie Brust, Gebärmutter und Schilddrüse wurde von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) bestätigt. Isoflavone in einer Konzentration von bis zu 150 mg täglich und über einen Zeitraum von bis zu drei Jahren sind sicher.
Isoflavone können somit als erstes Mittel der Wahl bei der Behandlung von natürlichen Hitzewallungen in den Wechseljahren empfohlen werden.
Originalquelle: Gynecol Endocrinol. 2016 Jun;32(6):427-30. doi: 10.3109/09513590.2016.1152240. Epub 2016 Mar 4. Consensus: soy isoflavones as a first-line approach to the treatment of menopausal vasomotor complaints. Schmidt M, Arjomand-Wölkart K, Birkhäuser MH, Genazzani AR, Gruber DM, Huber J, Kölbl H, Kreft S, Leodolter S, Linsberger D, Metka M, Simoncini T, Vrabic Dezman L.
Wechseljahre und Hitzewallungen
Die Verbindung zwischen einer erhöhten Aufnahme von Isoflavonen und einer reduzierten Häufigkeit von Hitzewallungen wurde erstmals im Jahre 1992 beschrieben. Sie war auf einer geringeren Häufigkeit von Hitzewallungen in Ländern mit einem hohen Sojakonsum basierend.1
Meta–Analysen und Bewertungen haben eine positive Wirkung der Isoflavone bei Wechseljahresbeschwerden wie Hitzewallungen, Schweißausbrüche, Depressionen, Schlafstörungen und Kopfschmerzen bestätigt.2–4
Die Prävalenz dieser Beschwerden zeigt deutliche Unterschiede in verschiedenen Regionen der Welt. Während sich 74% der europäischen Frauen über Hitzewallungen beschweren, sind es in Japan nur 5 %.5
Verschiedene Faktoren wie Rauchen, Koffein, Übergewicht und Stress können Hitzewallungen fördern. Da die Östrogen Ergänzungen die Hitzewallungen reduzieren können, scheint es offensichtlich, dass Hitzewallungen hormonell bedingt sind. Der genaue Mechanismus der Hitzewallungen ist jedoch nicht bekannt. Östrogenmangel allein ist nicht ausreichend, um die Symptome auszulösen. Paradoxerweise leiden übergewichtigen Frauen, die eine höhere Östrogenproduktion durch Biosynthese im Fettgewebe haben, unter mehr anstatt weniger Hitzewallungen.6
Viele, aber nicht alle epidemiologischen Studien bestätigen die umgekehrte Assoziation zwischen Isoflavonaufnahme und vasomotorischen Symptomen.7 Es ist aber wahrscheinlich, dass eine lebenslange Aufnahme ist besser als erst später Anfang im Leben.
Ernährung mit Soja–Produkten
Die Internationale Menopause Gesellschaft empfiehlt Isoflavone als „eine wirksame Alternative und Ergänzung zur Behandlung der Symptome der Wechseljahre und Prämenopause“.8,9
Eine Meta–Analyse hat festgestellt, dass Nahrungsergänzungsmittel mit Soja–Isoflavonen signifikant wirksamer als Placebo bei der Verringerung der Häufigkeit und Schwere von Hitzewallungen sind. Die Meta–Analyse, die die größte und am umfassendsten durchgeführt bis heute ist – hat festgestellt, dass die Soja–Isoflavone, die von sechs Wochen bis zwölf Monaten genommen wurden, die Häufigkeit von Hitzewallungen um mehr als 20 % im Vergleich zu Placebo reduzierten. Soja–Isoflavone haben auch signifikant den Schweregrad der Hitzewallungen um über 26 % im Vergleich zu Placebo reduziert.
Ein Review ergab, dass Isoflavone–Ergänzungen, die mehr als 18.8 mg Genistein bereitstellen (der Medianwert für alle Studien), mehr als doppelt so wirksam bei der Verringerung der Häufigkeit von Hitzewallungen als Nahrungsergänzungsmitteln mit einem niedrigeren Niveau von Genistein.10 Das zentrale Ergebnis dieser Studie ist, dass wenn man die Analyse auf Isoflavone–Ergänzungen aus Soja oder auf solche mit identischen Profilen wie Soja beschränkt, gibt es eine sehr konsistente Wirkung auf Hitzewallungenerleichterung gibt. Fast alle Studien in der Metaanalyse zeigen eine konsequente Reduktion der Hitzewallungen Häufigkeit und des Schweregrad.
Eine weitere Studie hat bestätigt, dass die Dosierung wichtig ist und hat gezeigt, dass eine hohe Dosis (100 bis 200 mg), mit einer Einnahmehäufigkeit von zwei– bis dreimal täglich den Vorteil der Isoflavone gegen Hitzewallungen verbessert, insbesondere bei Equol Herstellern und für die Nacht–Symptome.11 Die Ergebnisse können auch das negative Resultat in anderen Studien erklären, die auf niedrigeren Niveaus der Isoflavone und in westlichen Frauen basieren. 25% der westlichen Bevölkerung hat eine reduzierte Fähigkeit, den Wirkstoff Equol aus anderen Soja–Isoflavone zu produzieren.
Die neueste Rezension kam auch zu dem Schluss, dass Isoflavone–Ergänzungen konsequent Wechseljahren Hitzewallungen lindern, sowie positive Effekte fürs kardiovaskuläre System haben.12
Knochengesundheit
Soja–Isoflavone haben eine positive Wirkung auf die Gesundheit der Knochen. Allerdings ist hier die lebenslange Einnahme von Soja–Isoflavone am wirkungsvollsten. Die Ergebnisse einer doppelblinden, randomisierten Studie ergab, dass Soja–Protein–Nahrungsergänzungsmittel mit Isoflavonen die die Knochendichte, die kognitive Funktion oder die Plasmalipide bei gesunden Frauen nach der Menopause nicht verbessert haben, wenn im Alter von 60 Jahren oder später genommen.13
Die Messung der Knochenmineraldichte ist möglicherweise kein idealer Parameter für die Beurteilung der schützenden Isoflavoneffekte. Die Knochenfestigkeit scheint ein viel relevanterer Faktor zu sein, wenn es zur Verhinderung von Knochenbrüchen kommt. Eine Studie ergab, dass Soja–Lebensmittel die Bruchgefahr bei postmenopausalen Frauen verringert, vor allem bei denen in den ersten Jahren nach der Menopause.14
Die Effekte von Isoflavonen auf die Knochengesundheit ist wahrscheinlich von Menopausenstatus, Isoflavon–Dosis und der Art der Ergänzung abhängig. Wei et al. (2012) untersuchte die Wirkung von Soja–Isoflavonen auf die Prävention von Osteoporose und die wirksame Dosis von Soja–Isoflavonen und dessen Dauer. Soja–Isoflavone sind wahrscheinlich für die Verbesserung der Knochendichte besser als die Stimulierung eines neuen Wachstums. Vorsorge ist besser als Nachsorge.
Eine Meta–Analyse ergab, dass Soja–Isoflavone-Nahrungsergänzungsmittel die Knochendichte deutlich erhöhen und den Knochenresorption–Marker DPD im Urin vermindert haben. Allerdings fand sie keine signifikante Wirkung auf den Knochenbildung–Marker, alkalische Phosphatase. Die signifikante Wirkung von Soja–Isoflavonen auf die Knochendichte und Harn–DPD ist relativ zu Menopausenstatus, Nahrungsergänzungsmittel–Typ, Isoflavon–Dosis und Interventionsdauer.15
Insgesamt legen die Ergebnisse nahe, dass Isoflavone bei der Osteoporoseverhinderung bei Männern und Frauen helfen können, und das Frakturrisiko reduzieren, zumindest an der Hüfte bei den Frauen nach der Menopause, mit gleichzeitiger Reduzierung von Wechseljahresbeschwerden.16
Herz–Kreislauf Gesundheit
Meta–Analysen bestätigen, dass Soja das Gesamt–, LDL– Cholesterin und die Triglyceride, sowohl bei Patienten mit Hypercholesterinämie als auch bei Diabetes Typ II senkt. Soja–Nahrung reduziert Plasmagesamtcholesterin, LDL–Cholesterin und Triglyceride.17,18
Japanische Frauen haben eine niedrige Inzidenz und Mortalität von Brustkrebs und Herz–Kreislauf– Erkrankungen, und erleben weniger Symptome der Menopause im Vergleich zu Kaukasiern.19 Die Beobachtung, dass es mit Sojaprodukte in der Ernährung verbunden ist,20 wird zunehmend durch Untersuchungen unterstütz. Eine Studie von Soja–Protein reichen Isoflavonen auf Frauen in der Menopause hat die Verbesserung der Knochendichte, Bluthochdruck und Wechseljahrsbeschwerden gezeigt.21
Im Jahre 1999 hat die FDA (US Food and Drug Administration) die gesundheitsbezogene Angabe für Soja–Lebensmittel und koronare Herzkrankheit auf der Basis der hypocholesterinämischen Auswirkungen von Soja–Protein genehmigt. Die Ergebnisse der kürzlich veröffentlichten Meta–Analysen zeigen, dass Soja–Proteine direkt das zirkulierende LDL–Cholesterin („schlechtes“ Cholesterin) um rund 4% senken. Es gibt auch interessante Hinweise, dass Soja–Lebensmittel das KHK–Risiko unabhängig von deren Auswirkungen auf die Blutfettwerte reduzieren.22 Nur 30 g Sojaprotein täglich für zwei Monate ist gezeigt worden, eine günstige Wirkung auf die Serumlipide in 28 hyperlipidämischen Themen zu haben.23
In Übereinstimmung mit diesen Ergebnissen, empfiehlt die FDA 25g Soja–Protein pro Tag als Teil einer Ernährung, die arm an gesättigten Fetten zu Cholesterinsenkung ist.24–26
Die Beigabe von Soja–Lebensmitteln zu einer mediterranen Ernährung hat erreicht, die Werte von Gesamtcholesterin, Triglyceride, VLDL, LDL, Nicht–HDL–Cholesterin, apoB und Verhältnis von Triglyceriden zu HDL, Cholesterin zu HDL, apoB zu ApoA–1 als auch LDL–Partikel Nummer zu verbessern.27
Sojadrinks wurden mit weniger Fettansammlung, reduzierten Entzündungsmarkern, oxidativem Stress und verbessertem Plasma–Adiponektin in übergewichtigen Männer im Vergleich zu Kuhmilch in Verbindung gebracht .28 Der tägliche Konsum von Sojamilch verringert signifikant die atherogene Plasmacholesterin Konzentration. Dies deutet darauf hin, dass Soja–Drink ein wichtiges nicht–pharmakologisches Cholesterin senkendes Mittel sein könnte.29
Die mediterrane Ernährung ist eine der am meisten untersuchten Diäten und die Forschungsergebnisse belegen konsequent , dass die Mittelmeerdiät mit einem langen, gesunden Leben verbunden ist. Soja–Isoflavone haben gezeigt, dass sie die gesundheitlichen Vorteile einer Mittelmeerdiät verbessern.30 Die Studie fand heraus, dass die tägliche Einnahme von 40 mg Soja–Isoflavonen zusammen mit einer mediterranen Ernährung und Bewegung, die Insulinresistenz bei postmenopausalen Frauen verringert. Es war deutlich besser als die Änderungen des Lebensstils allein.
Die Ergebnisse einer anderen Studie legen nahe, dass Soja–Proteine in Kombination mit einer kalorienarmen vierwöchigen Diät eine sichere und wirksame Alternativtherapie sein kann, um die kardiovaskulären Risikofaktoren in hyperlipidämischen Patienten zu reduzieren. Serumlipidanomalien sind ein Risikofaktor für kardiovaskuläre Erkrankungen in hyperlipidämischen Patienten. Wegen der Nebenwirkung der Langzeitmedikation bei diesen Patienten können Sojaproteine, als ein Teil der Gesundheitsnahrung ihre Lipidprofil verbessern.31
52 hyperlipidämischen Patienten beider Geschlechter, im Alter von 25 bis 65 Jahren erhalten pro Tag für vier Wochen eine kalorienarme Diät auf 1400 kcal Energie Basis (18% Eiweiß, 24% Fett und 58% Kohlenhydrate). Die Behandlungsgruppe erhielt kalorienarme Diät, einschließlich 30 g Sojaproteine. Das Sojaprotein–kalorienarme Diät war nach vier Wochen mit einer signifikanten Gewichtsreduzierung, Body Mass Index, Taille und Hüfte Umfang (p<0.05) verbunden. Geringer Dichte Lipoprotein Serum war signifikant (p<0.05) verringert.31
Es ist wichtig zu beachten, dass eine vorteilhafte Wirkung auf Herz–Kreislauf Risikofaktoren auch in Nicht–Produzenten von Equol gesehen wird. Eine Studie fand heraus, dass Sojaprodukte in Equol Produzenten und Nicht–Produzenten das LDL–Cholesterin Serum gleichmäßig reduziert haben. Allerdings in Equol Produzenten (35%), hat der Sojakonsum den zusätzlichen kardiovaskulären Vorteil der Aufrechterhaltung höherer HDL–Cholesterin–Konzentrationen als in Equol Nicht–Produzenten.32
Nicht alle Studien haben eine positive Wirkung gezeigt. Eine Studie ergab, dass Soja–Proteine und/oder Soja–Isoflavone kleine Auswirkungen auf Blutfett– und Entzündungsmarker hatten33 und eine andere Studie ergab, dass 300 mg täglich von einer isolierten Isoflavone–Verbindung eine Änderung der Blutfette produzierte.34 Die Mehrheit der Studien haben jedoch positiven Effekt, vor allem beim Verzehr der ganzen Sojaprodukte.
Endotheldysfunktion
Endotheldysfunktion wurde als unabhängiger koronarer Herzkrankheit–Risikofaktor und ein starker Prädiktor für langfristigen kardiovaskulären Morbidität und Mortalität identifiziert. Die meisten Studien mit Soja–Isoflavonen deuten auf eine positive Wirkung.35–39 Es gibt aber auch Hinweise darauf, dass die Vorteile von Soja–Isoflavonen bei der Verhinderung von kardiovaskulären Erkrankungen offensichtlich innerhalb der Equol–Ausscheidern sein können.40
Isoflavone haben eine schützende Wirkung auf das Risiko von Arteriosklerose und arterielle Degeneration durch die Wirkung auf die Arterienwände, vor allem bei älteren Frauen gezeigt.41–43
Das metabolische Syndrom, Übergewicht und Diabetes
Das metabolische Syndrom ist eine Störung, die Adipositas, Diabetes und kardiovaskuläre Erkrankungen umfasst. Soja verbesserte das Lipid–Profile von älteren Frauen mit metabolischem Syndrom44. Sojamilch zeigte auch, eine wichtige Rolle bei der Verringerung der Taillenumfang von übergewichtigen und adipösen Patienten zu spielen.45 Nachweise aus Tier– und Beobachtungsstudien unterstützen die positive Wirkung von Soja–Aufnahme auf die glykämische Kontrolle.
Obwohl eine Überprüfung der randomisierten, kontrollierten Studien keinen signifikanten Gesamteffekt von Soja–Einnahme auf Verbesserungen der Nüchternglukose und Insulinkonzentrationen fanden, ergab eine Untergruppe–Analyse, dass die gesamten Sojaprodukte Nüchternglukose Konzentrationen verbessern.46 Eine kürzlich durchgeführte Meta–Analyse ergab, das die Soja–Produkte mit einer signifikanten Reduktion der Gesamt– und Triglyceride, wie auch niedrigdichtes Lipoprotein–Cholesterin („schlechtes“ Cholesterin), und mit einer signifikanten Erhöhung des hochdichten Lipoprotein–Cholesterin („gutes Cholesterin“) verbunden sind.
Es gab keine signifikanten Auswirkungen auf die Nüchternglukose, Insulin und glykiertes Hämoglobin. Die Autoren schlossen daraus, dass die Aufnahme von Soja und Sojaprodukten positive Auswirkungen in Typ II Diabetes Patienten in Bezug auf Serumlipide hat.47
Soja–Isoflavone–Supplementierung zeigten auch, vorteilhaft bei der Behandlung des metabolischen Syndroms zu sein. Eine systematische Überprüfung und Meta–Analyse hat ergeben, dass Soja–Isoflavone–Supplementierung vorteilhaft für die Reduzierung des Körpergewichts, Glukose und Insulin–Kontrolle im Plasma sein könnte.48 Die jährlichen Kosten der Behandlung mit 54 mg Genistein pro Tag hat auch die Verbesserung der Surrogatendpunkten mit Risiko für Diabetes und Herzkreislauferkrankungen bei postmenopausalen Frauen mit metabolischem Syndrom gezeigt.49
Bluthochdruck
Epidemiologische Studien deuten darauf hin, dass der Konsum von Soja die Inzidenz von kardiovaskulären Erkrankungen reduziert und mehreren kleinen klinischen Studien haben eine mögliche positive Wirkung von kurzfristigen Sojakonsum auf den Blutdruck vorgeschlagen.50–52 Eine Meta–Analyse hat gezeigt, dass Soja–Isoflavone einen Effekt der Senkung des Blutdrucks in hypertensiven Probanden, aber nicht in normotensiven Probanden hatten.53
Schlaganfall
Höhere Aufnahme von Isoflavonen in Schlaganfallpatienten wurde mit längerem rezidivfreiem Überleben und einem verringerten Risiko von Schlaganfall Wiederholung und schwerwiegenden unerwünschten kardiovaskulären Ereignisse unabhängig von der Baseline–Kreislauf–Funktion in Verbindung gebracht.54
Entzündung und Immunität
Das Immunsystem kann nach der Menopause aufgrund der Auswirkungen des Alterns und der abnehmenden Konzentrationen an Östrogen, das ein immunmodulierendes Hormon ist, beeinträchtigt werden. Eine randomisierte, kontrollierte Studie ergab, dass Isoflavone positive Auswirkungen auf CRP–Spiegel bei postmenopausalen Frauen haben. CRP ist ein Biomarker für Entzündungen und seine hohe Niveaus sind mit Entzündungen und Herzkrankheiten verbunden.55 Eine weitere Entzündung–Studie ergab, dass Isoflavonaufnahme eine oxidative Markierung von DNA–Schäden reduziert und die Marker der Immunität bei postmenopausalen Frauen verbessert hat.56 Junge Frauen mit einer überdurchschnittlich hohen Aufnahme an Isoflavonen in den USA wurden mit erniedrigter Serum–CRP–Konzentrationen, dem Faktor mit positiven Auswirkungen auf die Entzündung assoziiert. Auch kann es das Potenzial haben, den Gesundheitszustand von jungen Frauen zu verbessern und das Risiko von Herz–Kreislauf–Krankheit später im Leben zu reduzieren.57
Eine andere Studie ergab, dass eine gemäßigte Konditionstraining in Kombination mit einer auf Soja basierenden Proteinergänzung die aerobe Energieversorgung und Stoffwechselfunktion in gesunden Sport–Studenten, auch ohne Änderungen in der Körperzusammensetzung und ohne Veränderungen in der Ausübung–induzierten Stress und Entzündungsreaktion verbessert.58
Soja–Isoflavone sind wirksame Antioxidanten und schützen vor oxidativen Schäden. Die Ergebnisse der Studie fanden einen positiven Effekt von Isoflavon–Supplementierung auf oxidativen Stress bei Frauen heraus, was darauf schließen lässt, dass die gesunde Wirkung des Sojakonsums teilweise auf die antioxidative Potenzial der Isoflavone zurückgeführt werden kann. Die Studie ergab eine signifikante inverse Korrelation zwischen der DNA–Schäden und Plasma Isoflavone–Konzentrationen (p <0.01).59
Sojanahrung zeigte auch, die zirkulierenden Spiegel von Biomarkern für Entzündung, einschließlich IL–6, TNFa und lösliche TNF–Rezeptoren 1 und 2 in der chinesischen Frauen zu senken.60
Asthma und chronisch obstruktiven Atemwegserkrankungen
Sogar Asthma könnte sich mit Soja–Verbrauch in Japan zu verbessern. Zunehmender Sojaverbrauch wurde mit einem verringerten Risiko von COPD und Atemnot assoziiert.61 Die Ergebnisse einer Post–hoc–Analyse legen nahe, dass bei Patienten mit Asthma, der Konsum von mittleren bis hohen Mengen an Soja–Genistein mit besseren Lungenfunktion und einer besseren Asthmakontrolle verbunden wurde.62
Gicht
Der Verzehr von Fisch und rotes Fleisch verschlimmert oft die Gicht. Soja scheint eine gute Alternative dafür zu sein. Eine große Studie fand einen direkten Zusammenhang zwischen Fischkonsum und Hyperurikämie und eine inverse Assoziation zwischen Verzehr von Soja–Lebensmitteln und Hyperurikämie, unter chinesischen Männer im mittleren Alter, heraus.63
Referenzen
1. Adlercreutz H, Hamalainen E, Gorbach S, Goldin B. Dietary phyto-oestrogens and the menopause in Japan. Lancet. 1992;339(8803):1233.
2. Nelson HD, Vesco KK, Haney E, et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA. 2006;295(17):2057-2071.
3. Howes LG, Howes JB, Knight DC. Isoflavone therapy for menopausal flushes: a systematic review and meta-analysis. Maturitas. 2006;55(3):203-211.
4. Kurzer MS. Soy Consumption for Reduction of Menopausal Symptoms. Inflammopharmacology. 2008;16:1-3.
5. Nagata C, Shimizu H, Takami R, Hayashi M, Takeda N, Yasuda K. Hot flushes and other menopausal symptoms in relation to soy product intake in Japanese women. Climacteric : the journal of the International Menopause Society. 1999;2(1):6-12.
6. Thurston RC, Sowers MR, Chang Y, et al. Adiposity and Reporting of Vasomotor Symptoms among Midlife Women: The Study of Women’s Health Across the Nation. Am J.Epidemiol. 2008;167(1):78-85.
7. Gold EB, Leung K, Crawford SL, Huang MH, Waetjen LE, Greendale GA. Phytoestrogen and fiber intakes in relation to incident vasomotor symptoms: Results from the Study of Women’s Health Across the Nation. Menopause. 2013;20(3):308-314.
8. Anonymous. Positionspapier der Internationalen und österreichischen Menopausegesellschaft. Sekretariat Österreichische Menopausegesellschaft. 2007.
9. Schindler AE. Wie sinnvoll ist die Kombination von Sexualsteroiden und Phytohormonen? Gyne. 2006;(4) ( ):82-84.
10. Taku K, Melby MK, Kronenberg F, Kurzer MS, Messina M. Extracted or synthesized soybean isoflavones reduce menopausal hot flash frequency and severity: systematic review and meta-analysis of randomized controlled trials. Menopause. 2012;19(7):776-790.
11. Crawford SL, Jackson EA, Churchill L, Lampe JW, Leung K, Ockene JK. Impact of dose, frequency of administration, and equol production on efficacy of isoflavones for menopausal hot flashes: a pilot randomized trial. Menopause. 2013;20(9):936-945.
12. Messina M. Soy foods, isoflavones, and the health of postmenopausal women. The American journal of clinical nutrition. 2014.
13. Kreijkamp-Kaspers S, Kok L, Grobbee DE, et al. Effect of soy protein containing isoflavones on cognitive function, bone mineral density, and plasma lipids in postmenopausal women: a randomized controlled trial. JAMA. 2004;292(1):65-74.
14. Zhang X, Shu XO, Li H, et al. Prospective cohort study of soy food consumption and risk of bone fracture among postmenopausal women. Archives of internal medicine. 2005;165(16):1890-1895.
15. Wei P, Liu M, Chen Y, Chen DC. Systematic review of soy isoflavone supplements on osteoporosis in women. Asian Pacific journal of tropical medicine. 2012;5(3):243-248.
16. Castelo-Branco C, Cancelo Hidalgo MJ. Isoflavones: effects on bone health. Climacteric : the journal of the International Menopause Society. 2011;14(2):204-211.
17. Anderson JW, Johnstone BM, Cook-Newell ME. Meta-analysis of the effects of soy protein intake on serum lipids. The New England journal of medicine. 1995;333(5):276-282.
18. Anderson JW, Bush HM. Soy protein effects on serum lipoproteins: a quality assessment and meta-analysis of randomized, controlled studies. Journal of the American College of Nutrition. 2011;30(2):79-91.
19. Zhang X, Shu XO, Gao YT, et al. Soy food consumption is associated with lower risk of coronary heart disease in Chinese women. J.Nutr. 2003;133(9):2874-2878.
20. Kobayashi S. Trends in national nutritional survey of Japan. Nutr.Health. 1992;8(2-3):91-96.
21. Watanabe S, Uesugi S, Kikuchi Y. Isoflavones for prevention of cancer, cardiovascular diseases, gynecological problems and possible immune potentiation. Biomed.Pharmacother. 2002;56(6):302-312.
22. Messina M, Messina V, Jenkins DJ. Can breast cancer patients use soyafoods to help reduce risk of CHD? The British journal of nutrition. 2012;108(5):810-819.
23. Borodin EA, Menshikova IG, Dorovskikh VA, et al. Effects of two-month consumption of 30 g a day of soy protein isolate or skimmed curd protein on blood lipid concentration in Russian adults with hyperlipidemia. Journal of nutritional science and vitaminology. 2009;55(6):492-497.
24. Food labeling: health claims; soy protein and coronary heart disease. Food and Drug Administration, HHS. Final rule. Fed.Regist. 1999;64(206):57700-57733.
25. Stein K. FDA approves health claim labeling for foods containing soy protein. J.Am.Diet.Assoc. 2000;100(3):292.
26. Messina M. Investigating the optimal soy protein and isoflavone intakes for women: a perspective. Womens Health (Lond Engl.). 2008;4(4):337-356.
27. Chang JL, McIntosh M, Fernandez ML, et al. A soy-based medical food enhances the efficacy of a mediterranean-style low-glyceic-load dietary protram for cardiovascular risk reduction in women with metabolic syndrome. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
28. Gonzalez de Mejia E, Fernendez D, Martinez-Villaluenga C, Bringe NA. Soy milk produced less fat accumulation, decreased markers of inflammation and oxidative stress and enhanced plasma adiponectin in overweight men. 9th International Symposium on the Role of Soy in Health Promotion and Chronic Disease Prevention and Treatment, Washington DC, 16-19 October. 2010.
29. Onuegbu AJ, Olisekodiaka JM, Onibon MO, Adesiyan AA, Igbeneghu CA. Consumption of soymilk lowers atherogenic lipid fraction in healthy individuals. Journal of medicinal food. 2011;14(3):257-260.
30. Llaneza P, Gonzalez C, Fernandez-Inarrea J, et al. Soy isoflavones, Mediterranean diet, and physical exercise in postmenopausal women with insulin resistance. Menopause. 2010;17(2):372-378.
31. Noroozi M, Zavoshy R, Jahanihashemi H. The effects of low calorie diet with soy protein on cardiovascular risk factors in hyperlipidemic patients. Pakistan journal of biological sciences: PJBS. 2011;14(4):282-287.
32. Wong JMW, Kendall CWC, Marchie A, et al. Equol status and blood lipid profile in hyperlipidemia after consumption of diets containing soy foods. American Journal of Clinical Nutrition. 2012;95(3):564-571.
33. Mangano KM, Hutchins-Wiese HL, Kenny AM, et al. Soy proteins and isoflavones reduce interleukin-6 but not serum lipids in older women: a randomized controlled trial. Nutrition research (New York, N.Y.). 2013;33(12):1026-1033.
34. Hsu CS, Shen WW, Hsueh YM, Yeh SL. Soy isoflavone supplementation in postmenopausal women. Effects on plasma lipids, antioxidant enzyme activities and bone density. J.Reprod.Med. 2001;46(3):221-226.
35. Squadrito F, Altavilla D, Crisafulli A, et al. Effect of genistein on endothelial function in postmenopausal women: a randomized, double-blind, controlled study. The American journal of medicine. 2003;114(6):470-476.
36. Lissin LW, Oka R, Lakshmi S, Cooke JP. Isoflavones improve vascular reactivity in post-menopausal women with hypercholesterolemia. Vascular medicine. 2004;9(1):26-30.
37. Hallund J, Bugel S, Tholstrup T, et al. Soya isoflavone-enriched cereal bars affect markers of endothelial function in postmenopausal women. The British journal of nutrition. 2006;95(6):1120-1126.
38. Azadbakht L, Kimiagar M, Mehrabi Y, Esmaillzadeh A, Hu FB, Willett WC. Soy consumption, markers of inflammation, and endothelial function: a cross-over study in postmenopausal women with the metabolic syndrome. Diabetes Care. 2007;30(4):967-973.
39. Beavers DP, Beavers KM, Miller M, Stamey J, Messina MJ. Exposure to isoflavone-containing soy products and endothelial function: a Bayesian meta-analysis of randomized controlled trials. Nutrition, metabolism, and cardiovascular diseases : NMCD. 2012;22(3):182-191.
40. Cai Y, Guo K, Chen C, et al. Soya isoflavone consumption in relation to carotid intima-media thickness in Chinese equol excretors aged 40-65 years. The British journal of nutrition. 2012;108(9):1698-1704.
41. van der Schouw YT, Pijpe A, Lebrun CE, et al. Higher usual dietary intake of phytoestrogens is associated with lower aortic stiffness in postmenopausal women. Arteriosclerosis, thrombosis, and vascular biology. 2002;22(8):1316-1322.
42. Colacurci N, Chiantera A, Fornaro F, et al. Effects of soy isoflavones on endothelial function in healthy postmenopausal women. Menopause. 2005;12(3):299-307.
43. Chan YH, Lau KK, Yiu KH, et al. Isoflavone intake in persons at high risk of cardiovascular events: implications for vascular endothelial function and the carotid atherosclerotic burden. The American journal of clinical nutrition. 2007;86(4):938-945.
44. Bakhtiary A, Yassin Z, Hanachi P, Rahmat A, Ahmad Z, Jalali F. Effects of soy on metabolic biomarkers of cardiovascular disease in elderly women with metabolic syndrome. Archives of Iranian medicine. 2012;15(8):462-468.
45. Keshavarz SA, Nourieh Z, Attar MJH, Azadbakht L. Effect of soymilk consumption on waist circumference and cardiovascular risks among overweight and obese female adults. International Journal of Preventive Medicine. 2012;3(11):798-805.
46. Liu ZM, Chen YM, Ho SC. Effects of soy intake on glycemic control: a meta-analysis of randomized controlled trials. The American journal of clinical nutrition. 2011;93(5):1092-1101.
47. Yang B, Chen Y, Xu T, et al. Systematic review and meta-analysis of soy products consumption in patients with type 2 diabetes mellitus. Asia Pacific journal of clinical nutrition. 2011;20(4):593-602.
48. Zhang YB, Chen WH, Guo JJ, et al. Soy isoflavone supplementation could reduce body weight and improve glucose metabolism in non-Asian postmenopausal women-A meta-analysis. Nutrition. 2013;29(1):8-14.
49. Squadrito F, Marini H, Bitto A, et al. Genistein in the metabolic syndrome: results of a randomized clinical trial. The Journal of clinical endocrinology and metabolism. 2013;98(8):3366-3374.
50. Yang G, Shu XO, Jin F, et al. Longitudinal study of soy food intake and blood pressure among middle-aged and elderly Chinese women. The American journal of clinical nutrition. 2005;81(5):1012-1017.
51. Teede HJ, McGrath BP, DeSilva L, Cehun M, Fassoulakis A, Nestel PJ. Isoflavones reduce arterial stiffness: a placebo-controlled study in men and postmenopausal women. Arteriosclerosis, thrombosis, and vascular biology. 2003;23(6):1066-1071.
52. Azadbakht L, Nurbakhsh S. Effect of soy drink replacement in a weight reducing diet on anthropometric values and blood pressure among overweight and obese female youths. Asia Pacific journal of clinical nutrition. 2011;20(3):383-389.
53. Liu XX, Li SH, Chen JZ, et al. Effect of soy isoflavones on blood pressure: a meta-analysis of randomized controlled trials. Nutrition, metabolism, and cardiovascular diseases : NMCD. 2012;22(6):463-470.
54. Chan YH, Lau KK, Yiu KH, et al. Prospective observational study of isoflavone and the risk of stroke recurrence: Potential clinical implications beyond vascular function. Journal of Nutrition, Health and Aging. 2012;16(4):383-388.
55. Hall WL, Vafeiadou K, Hallund J, et al. Soy-isoflavone-enriched foods and inflammatory biomarkers of cardiovascular disease risk in postmenopausal women: interactions with genotype and equol production. The American journal of clinical nutrition. 2005;82(6):1260-1268; quiz 1365-1266.
56. Ryan-Borchers TA, Park JS, Chew BP, McGuire MK, Fournier LR, Beerman KA. Soy isoflavones modulate immune function in healthy postmenopausal women. The American journal of clinical nutrition. 2006;83(5):1118-1125.
57. Filiberto AC, Mumford SL, Pollack AZ, et al. Habitual dietary isoflavone intake is associated with decreased C-reactive protein concentrations among healthy premenopausal women. The Journal of nutrition. 2013;143(6):900-906.
58. Berg A, Schaffner D, Pohlmann Y, et al. A soy-based supplement alters energy metabolism but not the exercise-induced stress response. Exercise immunology review. 2012;18:128-141.
59. Erba D, Casiraghi MC, Martinez-Conesa C, Goi G, Massaccesi L. Isoflavone supplementation reduces DNA oxidative damage and increases O-(beta)-N-acetyl-d-glucosaminidase activity in healthy women. Nutrition Research. 2012;32(4):233-240.
60. Wu SH, Shu XO, Chow WH, et al. Soy food intake and circulating levels of inflammatory markers in Chinese women. Journal of the Academy of Nutrition and Dietetics. 2012;112(7):996-1004, 1004 e1001-1004.
61. Hirayama F, Lee AH, Binns CW, et al. Soy consumption and risk of COPD and respiratory symptoms: a case-control study in Japan. Respiratory research. 2009;10:56.
62. Bime C, Wei CY, Holbrook J, Smith LJ, Wise RA. Association of dietary soy genistein intake with lung function and asthma control: A post-hoc analysis of patients enrolled in a prospective multicentre clinical trial. Primary Care Respiratory Journal. 2012;21(4):398-404.
63. Villegas R, Xiang YB, Elasy T, et al. Purine-rich foods, protein intake, and the prevalence of hyperuricemia: the Shanghai Men’s Health Study. Nutrition, metabolism, and cardiovascular diseases : NMCD. 2012;22(5):409-416.
Die klinische Forschung
Keine Informationen vorhanden.


